
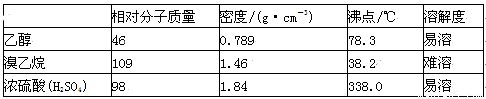
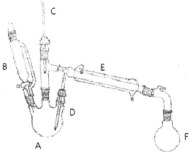
溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
主反应:NaBr+H2SO4 HBr+NaHSO4;C2H5OH+HBr
HBr+NaHSO4;C2H5OH+HBr C2H5Br+H2O
C2H5Br+H2O
副反应:在该实验中经常会有乙醚、溴等副产物生成。
实验步骤:
①向A中先加入5 mL 95%的无水乙醇(0.085 mol)和4.5 mL的水,加入溴化钠7.725g,再加入沸石,摇匀。在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中。
②在B中加入9.5 mL浓硫酸(0.17 mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2 mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g。
回答问题:
(1)仪器A的名称为_________
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是__________;饱和亚硫酸氢钠溶液的作用是________________
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有________(填标号)。
a.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 d.减少因浓硫酸氧化HBr而生成副产物溴
(4)步骤③中分出馏出液中有机层的操作名称为________;加入浓硫酸除杂后的溶液明显分层,粗产物在________层(填“上”或“下”)。
(5)本实验的产率为________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:推断题
A、B和C为短周期非金属元素,原子序数依次减小,A的最低负化合价为-2,无最高正价,B是空气中含量最高的元素,C最外层电子数与电子层数相等。回答下列问题:
(1)A、B和C分别为__________、____________、_____________(用元素名称表示)。
(2)由以上元素组成的化合物中,属于离子化合物的是___________,属于共价化合物的是_________。(各写一种即可)
(3)B的常见气态氢化物的电子式为_______________,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有____________(填化学键的种类),该离子氯化物的水溶液呈__________性,用离子方程式表示为_______________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:填空题
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
(1)测定蓝矾属于晶体的物理方法是____________。其中SO42-中S原子的轨道杂化形式是____________;H2O的空间构型是__________________。
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是__________(化学式);A溶于水配成溶液,加入氨水,观察到的现象是_____________________________________________;最终得到溶液中的含铜元素的离子是_________________(化学式),该离子含有的化学键类型有___________________。
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是____________;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。

①该温度是_______________。
②铜原子的配位数是_______________。
③已知该晶体的密度为dg·cm-3,则晶胞参数是_________________pm。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种元素.其相关信息如下:

请回答下列问题。
(1)写出E元素原子基态时M层的电子排布式_____________;
(2)C元素单质分子中含有δ和π键的键数之比为_____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:_____________ ;C2A4分子中C原子轨道的杂化类型是_____________;
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有_____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为_____________(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
(5) 三硫化四磷是黄绿色针状结晶,其结构如图所示。三硫化四磷分子中P原子采取_____________杂化,与PO3-互为等电子体的化合物分子的化学式为_____________,用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_____________。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:选择题
用一种试剂就能将下列五种有机物区分开来,①乙酸;②乙醛;③苯;④苯酚:⑤四氯化碳;这种试剂可以是
A.酸性高锰酸钾溶液 B.溴水
C.新制的氢氧化铜悬浊液 D.氯化铁溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:选择题
桂皮酸、布洛芬和阿司匹林均为某些药物的有效成分,其结构简式如下:

以下关于这三种有机物的说法中,不正确的是
A.都能与Na2CO3溶液反应产生CO2
B.一定条件下,均能与乙醇发生取代反应
C.只有桂皮酸可与溴的四氯化碳溶液发生加成反应
D.1mol阿司匹林最多能与2mol NaOH反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:选择题
将4molA气体和2molB气体在2L的容器中混合,在一定条件下发生如下反应:2A(g) +B(g)  2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:①用物质A的浓度变化表示的反应速率为0.3mol·L-1·s-1,②用物质B的浓度变化表示的反应速率为0.6 mol·L-1·s-1,③平衡时物质A的转化率为70%,④平衡时物质B的浓度为0.7mol·L-1,其中正确的是()
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:①用物质A的浓度变化表示的反应速率为0.3mol·L-1·s-1,②用物质B的浓度变化表示的反应速率为0.6 mol·L-1·s-1,③平衡时物质A的转化率为70%,④平衡时物质B的浓度为0.7mol·L-1,其中正确的是()
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一下期中化学试卷(解析版) 题型:选择题
空间实验室“天宫一号”的供电系统中有 再
再 生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确是 ( )
生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确是 ( )

A.转移0.1mol电子时,a电极产生1.12LO2(标准状况)
B.b电极上发生的电极反应是: 2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com