
【题目】下列实验操作中错误的是( )
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 称量NaOH时,称量物放在称量纸上,置于托盘天平的左盘中
C. 过滤时,漏斗下端紧贴烧杯内壁
D. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四种不同情况下,可逆反应A(g)+2B(g)C(g)+D(g)的反应速率如下,其中反应进行得最快的是
A. v(A)=0.15 mol/(L·min) B. v(B)=0.6 mol/(L·min)
C. v(C)=0.4 mol/(L·min) D. v(D)=0.02 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种离子化合物分别由Ba2+、NH4+、Na+、Mg2+中的一种和OH-、HSO4-、CO32-、Cl-中的一种组成。为确定其组成,某兴趣小组做了以下实验:
①配制浓度均为0.1mol/L的四种溶液,测其PH,其中B的PH大于13,C的PH大于7。
②将足量的B溶液与A溶液混合并微热,生成了白色沉淀与刺激性气味气体。
据此请回答下列问题:
(1)D的化学式为____,A在水中的电离方程式为____;
(2)A与B按物质的量之比2:1在水溶液中进行反应的离子方程式为___;
(3)已知CH3COONH4溶液呈中性,如将等浓度、等体积的A溶液滴加到C溶液中,所得混合液呈____性(填“酸”、“碱”、“中”),各离子浓度由大到小的顺序为____;
(4)将C和D的溶液分别蒸干并灼烧,所得固体分别是____。(填化学式)
(5)分别向含有0.15molB的溶液中加入100mL和200mL的A溶液并加热收集生成的气体,所得气体在标准状况下的体积均为VL,则V等于____,所加A溶液的物质的量浓度为____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按只含离子键、只含共价键、既含离子键又含共价键的顺序排列的是
A. 氯气 二氧化碳 氢氧化钠 B. 氯化钠 过氧化钠 氯化铵
C. 氯化钠 过氧化氢 氯化铵 D. 氯化钠 氦气 氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5KJ的热量,请写出该反应的热化学方程式____;
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____。
②在该温度下,计算该反应的平衡常数K=____。
③下列选项中能表示该反应已达到平衡状态的是____
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是____;
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是____;
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | span>φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
(4)合成气制甲醚的反应方程式为2CO(g) + 4H2(g)![]() CH3OCH3(g)+ H2O(g) △H = b kJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、 压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如下图所示。
CH3OCH3(g)+ H2O(g) △H = b kJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、 压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如下图所示。

① 290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是____;
② b____0,(填“>”或“<”或“=”)理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从硫化物中提取单质锑,经历以下两个过程:①2Sb2S3+3O2+6Fe![]() Sb4O6+6FeS ②Sb4O6+6C
Sb4O6+6FeS ②Sb4O6+6C![]() 4Sb+6CO↑,关于反应①、②的说法不正确的是( )
4Sb+6CO↑,关于反应①、②的说法不正确的是( )
A. 反应①中锑元素被氧化
B. 反应②中锑元素被还原
C. 标准状况下,每生成4 mol Sb时,消耗67.2 L O2
D. 反应②说明高温下C的还原性比Sb强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Cl-、SO42—、Fe3+、K+、M,且离子的物质的量之比为2:3:1:3:1,则微粒M为( )
A. Na+ B. S2- C. Mg2+ D. Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙烯时,常因温度过高而发生副反应.部分乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑.请用下列编号为①~④的实验装置设计一个实验,以验证上述反应后的混合气中含有二氧化碳、二氧化硫和水蒸气.

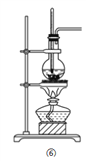
(1)用装置的编号表示其连接顺序(按气体产物从左到右的流向)__________________;
(2)装置⑤中的固体药品为__________________用以验证的产物是__________________,现象是__________________;
(3)装置①中的现象是__________________,验证__________________;装置②中溴水的作用是__________________;装置③中品红溶液不褪色说明__________________;此时盛有__________________的装置④中出现__________________,可以验证__________________气体的存在。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com