
分析 (1)根据反应 H2SO4+BaCl2=2HCl+BaSO4↓可知每份溶液中硫酸的物质的量=硫酸钡的物质的量,根据n=$\frac{m}{M}$计算出硫酸钡的物质的量,再根据c=$\frac{n}{V}$计算出硫酸的浓度;
然后根据酸碱中和反应的实质计算出每份溶液中氢离子的物质的量,再根据硫酸的物质的量计算出氯化氢的物质的量,最后根据c=$\frac{n}{V}$计算出氯化氢的浓度;
(2)第一份过滤后的滤液中加入足量的AgNO3溶液,生成氯化银的物质的量与氯离子的物质的量相等,根据m=nM计算出生成氯化银沉淀的质量.
解答 解:(1)混酸中只有硫酸和氯化钡反应生成沉淀,反应方程式为 H2SO4+BaCl2=2HCl+BaSO4↓,生成的9.32沉淀为硫酸钡,其物质的量为:$\frac{9.32g}{233g/mol}$=0.04mol,根据反应方程式可知每份溶液中含有硫酸的物质的量为0.04mol,所以混合液中硫酸的物质的量浓度是:$\frac{0.04mol}{0.01L}$=4mol/L;
第二份中加入50mL 2mol/L的NaOH溶液,恰好和溶液中的H+发生中和,说明氢离子的物质的量和OH-的物质的量相等,则每份溶液中含有氢离子的物质的量为:n(H+)=n(NaOH)=2mol/L×0.05L=0.1mol,其中硫酸电离的氢离子的物质的量为:0.1mol-0.04mol×2=0.02mol,
则每份溶液中HCl的物质的量浓度为:c(HCl)=$\frac{0.02mol}{0.01L}$=2mol/L,
答:混合溶液中H2SO4、HCl的物质的量浓度分别为4mol/L、2mol/L;
(2)在第一份过滤后的滤液中加入足量的AgNO3溶液,最终生成的AgCl沉淀的物质的量=氯离子的物质的量=0.02mol,则生成的AgCl的质量为:143.5g/mol×0.02mol=2.87g,
答:终生成的AgCl沉淀的质量是2.87g.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g NaOH固体溶解在水中配成250mL溶液 | |
| B. | 将80g SO3溶于水并配成1L的溶液 | |
| C. | 将100mL浓度为0.5mol/L的NaNO3溶液加热蒸发50克水 | |
| D. | 标况下,将22.4L氯化氢气体溶于水配成1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→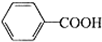 ↓+KCl
↓+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -96 | 不溶 | 易容 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 (100℃升华) | 25℃0.35g 80℃2.7g | 易容 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其它 | 阳离子核外无电子 | 可做半导体材料 | 焰色反应呈黄色 |
 ,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.
,R在自然界中有质量数为35和37的两种核素,它们之间的关系互为同位素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com