
分析 HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的$\frac{3}{5}$就停止了,则氯化氢体积=$\frac{3}{5}$VL,溶液体积为$\frac{3}{5}$VL,n(HCl)=$\frac{\frac{3}{5}VL}{22.4L/mol}$=$\frac{\frac{3V}{5}}{22.4}$mol,根据c=$\frac{n}{V}$计算盐酸浓度.
解答 解:HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的$\frac{3}{5}$就停止了,则氯化氢体积=$\frac{3}{5}$VL,溶液体积为$\frac{3}{5}$VL,n(HCl)=$\frac{\frac{3}{5}VL}{22.4L/mol}$=$\frac{\frac{3V}{5}}{22.4}$mol,则盐酸物质的量浓度=$\frac{\frac{\frac{3V}{5}}{22.4}mol}{\frac{3}{5}VL}$=$\frac{1}{22.4}$mol/L,
故答案为:$\frac{1}{22.4}$mol/L.
点评 本题考查物质的量的有关计算,为高频考点,明确水上升体积与HCl气体体积关系是解本题关键,熟悉物质的量公式中各个物理量的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
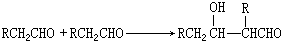
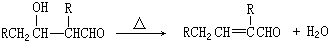
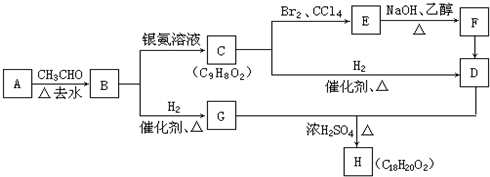
 ;
; +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O
+2NaBr+2H2O +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$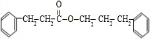 +H2O.
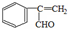
+H2O.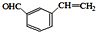 、
、 、
、
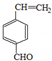 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| B. | 工业燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若同时使用硫酸亚铁和氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 航天服的主要成分是碳化硅、陶瓷和碳纤维,它们都属于无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | 原子半径:W>Z>X | |
| B. | 非金属性:Z>Y | |
| C. | 最高化合价:Z>X | |
| D. | 最高价氧化物对应水化物的酸性:W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
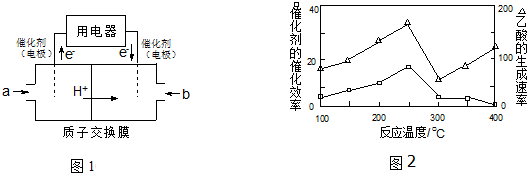
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液与CH3COOHNH4溶液均显中性,两溶液中水的电离程度相同 | |
| B. | CH3COONa溶液加水稀释:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 在NaHSO3溶液中,c(H+)+c(H2SO3)=c(OH-)+c(SO32-) | |
| D. | 含有AgCl和AgBr固体的悬浊液:c(Ag+)>c(Cl-)=c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
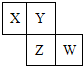 X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 非金属性:W>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:X>Y>Z | |
| D. | 最高正化合价:W>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙色 |
| ② | 向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com