
分析 HCl是一种无色具有刺激性气味的气体,实验室用NaCl和浓硫酸反应制备HCl,工业上用氢气与氯气反应生成HCl,HCl的水溶液为盐酸.
解答 解:常温下,HCl是一种无色具有刺激性气味的气体,实验室用NaCl和浓硫酸反应制备HCl,其反应方程式为:NaCl+H2SO4$\frac{\underline{\;加热\;}}{\;}$NaHSO4+HCl↑,工业上用氢气与氯气反应生成HCl,其反应方程式为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;HCl极易溶于水,其水溶液称为盐酸;
故答案为:无;刺激性;NaCl+H2SO4$\frac{\underline{\;加热\;}}{\;}$NaHSO4+HCl↑;H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;盐酸.
点评 本题考查了HCl的物理性质和制备方法,注意实验室制法与工业制法的区别,题目难度不大,侧重于教材上基础知识的考查.


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)═c(CCl3COO-)+c(CH3COO-) | |
| B. | c(CCl3COO-)-c(CH3COO-)═c(CH3COOH)-c(CCl3COOH) | |
| C. | c(OH-)>c(CCl3COO-)>c(CH3COO-) | |
| D. | c(CH3COOH)>c(CCl3COOH)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )| A. | 原混合溶液中NO${\;}_{3}^{-}$的物质的量的浓度为4mol/L | |
| B. | AB段的反应为:Fe+2Fe3+=3Fe2+ | |
| C. | C点时,乙中溶质为FeSO4 | |
| D. | 标准状况下,OA,OB段产生的气体总体积约为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”).
该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:| 实验编号 | 温度 | 0 | 10 | 20 | 40 | 50 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
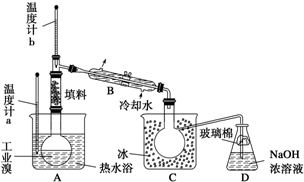 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图:
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com