

| ||
| 2.1g |
| 6.3g |
| 2.94g |
| 6.3g |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、若甲乙两气体质量相同,则甲乙两气体分子数一定相同 |
| B、若甲的相对分子质量比乙小,则甲的密度比乙的密度大 |
| C、若甲乙两气体的体积相同,则甲乙两气体的原子数一定相同 |
| D、甲乙两种气体的气体摩尔体积一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜与稀硝酸反应:3Cu+2NO3-+4H+=3Cu2++2NO2↑+2H2O |
| B、NO2气体与水反应:3NO2+H2O=2H++2NO3-+NO |
| C、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、AlCl3溶液中加入氨水:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
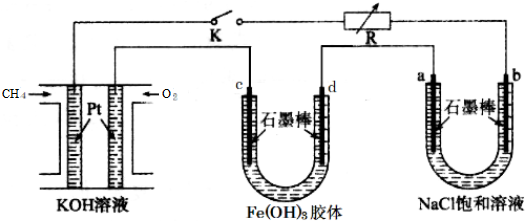
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 |
| B、原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀 |
| C、金属发生化学腐蚀还是电化学腐蚀的主要区别在于金属的纯度不同 |
| D、无论哪种类型的腐蚀,其实质都是金属被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4+2NaOH=Na2SO4+2H2O |
| B、2FeCl3+Cu=2FeCl2+CuCl2 |
| C、Mg3N 2+6H2O=3Mg(OH)2↓+2NH3↑ |
| D、NaCl+AgNO3=NaNO3+AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某溶液中可能含有H+、NH、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.
某溶液中可能含有H+、NH、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.| A、溶液中的阳离子有H+、NH4+、Mg2+、Al3+ |
| B、溶液中n(NH4+)=0.2 mol |
| C、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| D、n(H+):n(Al3+):n(Mg2+)=1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com