
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA | NaOH | 混合溶液的pH |
| 甲 | [HA]=0.2 mol·L-1 | [NaOH]=0.2 mol·L-1 | pH=a |
| 乙 | [HA]=c1 mol·L-1 | [NaOH]=0.2 mol·L-1 | pH=7 |
| 丙 | [HA]=0.1 mol·L-1 | [NaOH]=0.1 mol·L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
科目:高中化学 来源: 题型:单选题
能说明醋酸是弱电解质的事实是:
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5
| A.①③④ | B.①② | C.②④ | D.② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: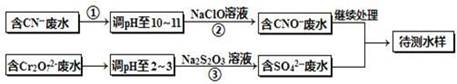
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
| A.x ="0.5" ,a =8 | B.x =0.5,a = 10 |
| C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。②K (Ni(OH)
(Ni(OH) ): 5.0×10-16 ,K
): 5.0×10-16 ,K (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物之一 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀?
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:难溶电解质Cu(OH)2在常温下的Ksp=2×10-20,则常温下:
(1)某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2 mol·L-1的盐酸进行滴定,完成下列问题:
(1)称取5.0 g该氢氧化钠固体样品,配成500 mL溶液备用。
(2)将标准盐酸装在25.00 mL的________滴定管中,调节液面位置在“0”刻度以下,并记录下刻度。
(3)取20.00 mL待测液。该项实验操作使用的主要仪器有________。用酚酞作指示剂时,滴定到溶液颜色由________色刚好变成________色为止。
(4)滴定达终点后,记下盐酸用去20.00 mL,计算氢氧化钠的质量分数为________。
(5)试分析上述滴定误差可能由下列哪些实验操作引起________(填序号)。
| A.转移待测液至容量瓶时,未洗涤烧杯 |
| B.酸式滴定管用蒸馏水洗涤后,直接装盐酸 |
| C.滴定时反应器摇动太激烈,有少量液体溅出 |
| D.滴定到终点时,滴定管尖嘴悬有气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)25 ℃时,0.1 mol·L-1 NaOH溶液的pH为 ;
(2)25 ℃时,0.1 mol·L-1 NH4Cl溶液的pH 7(填“<”“=”或“>”),其原因是 (用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是 (填序号)。
| A.c(Na+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C.c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| D.c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
若100 ℃时纯水电离出的H+浓度为1.0×10-6 mol·L-1,则此时KW= ,c(OH-)= ;25 ℃时的c(H+)=10-2 mol·L-1的硫酸溶液和c(H+)=10-12 mol·L-1的氢氧化钠溶液温度均升高到100 ℃,H+浓度分别是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)有强氧化性,是一种安全性很高的水处理剂。
(1)高铁酸钾中铁元素的化合价是 ,它可以将废水中的亚硝酸钾(KNO2)氧化,同时生成具有吸附性的Fe(OH)3,该反应的化学方程式为 。
(2)某学习小组用废铁泥(主要成分为Fe3O3、FeO、CuO和少量Fe)制备高铁酸钾的流程如下:
①操作Ⅰ要在通风橱中进行,其原因是 。
②溶液A中含有的金属阳离子是 。
③25℃时,若将溶液B中的金属离子完全沉淀,应调节c(H+)小于 。(已知:i. Ksp[Fe(OH)3]=2.7×10-39、Ksp[Fe(OH)2] =4.0×10-17、Ksp[Cu(OH)2] =1.6×10-20;ii. 溶液中离子浓度小于10-5 mol·L-1时,可视为沉淀完全。)
④该小组经多次实验,得到如图结果,他们的实验目的是 。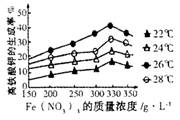
(3)高铁酸钾还可以用电解法制取,电解池以铁丝网为阳极,电解液使用氢氧化钾溶液,其阳极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com