
分析 (1)海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰;
(2)当AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,因此可以根据溶度积表达式进行计算,溶液中 $\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$;
(3)正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量;
(4)依据化学平衡三行计算列式,在457.6℃时,将0.2molH2和0.1mol I2气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得HI的体积分数为20%,设反应的氢气物质的量浓度为x,
H2(g)+I2(g)?2HI(g),
起始量(mol/L) 0.02 0.01 0
变化量(mol/L) x x 2x
平衡量(mol/L)0.02-x 0.01-x 2x
结合碘化氢体积分数计算x,平衡常数等于生成物浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
(5)该温度下0.01mol/L的NaIO溶液中存在水解平衡,IO-+H2O?HIO+OH-,Kh=$\frac{c(O{H}^{-})c(HIO)}{c(I{O}^{-})}$=$\frac{Kw}{Ka}$.
解答 解:(1)海藻中的碘元素以碘化物形式存在,反应中I元素发生氧化反应,Mn元素被还原,还原产物应为硫酸锰,故答案为:MnSO4;
(2)当AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,因此可以根据溶度积表达式进行计算,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$=$\frac{8.5×1{0}^{-17}}{1.8×1{0}^{-10}}$$\frac{8.5×1{0}^{-17}}{1.7×1{0}^{-10}}$=5.0×10-7,
故答案为:5.0×10-7;
(3)2HI(g)?H2(g)+I2(g)△H=+11kJ•mol-1,设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-436kJ-151kJ=11kJ,解得x=299,
故答案为:299;
(4)设反应的氢气物质的量浓度为x,
H2(g)+I2(g)?2HI(g),
起始量(mol/L) 0.02 0.01 0
变化量(mol/L) x x 2x
平衡量(mol/L)0.02-x 0.01-x 2x
$\frac{2x}{0.02-x+0.01-x+2x}$×100%=20%
x=0.003mol/L,
平衡常数K=$\frac{{c}^{2}(HI)}{c({I}_{2})c({H}_{2})}$=$\frac{(2×0.003)^{2}}{(0.02-0.003)(0.01-0.003)}$=0.3,
故答案为:0.3;
(5)25℃时HIO的电离常数为2.5×10-9,则该温度下0.01mol/L的NaIO溶液中存在水解平衡,IO-+H2O?HIO+OH-,Kh=$\frac{c(O{H}^{-})c(HIO)}{c(I{O}^{-})}$=$\frac{c(O{H}^{-})c(HIO)}{c(I{O}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{2.5×1{0}^{-9}}$=4×10-6,c(OH-)=$\sqrt{\frac{4×1{0}^{-6}}{0.01}}$=2×10-4mol/L,c(H+)=$\frac{1{0}^{-14}}{2×1{0}^{-4}}$=5×10-11mol/L,
PH=-lgc(H+)=11-lg5=11-0.7=10.3,故答案为:10.3.
点评 本题比较综合,涉及考查氧化还原反应、反应热计算、化学平衡常数计算等,属于拼合型题目,侧重考查学生自学能力、分析解决问题的能力,注意水解平衡和电离平衡的关系计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
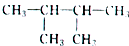 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对水加热到100℃,测得pH=6 | B. | 在水中滴入稀硫酸 | ||
| C. | 在水中加入小苏打 | D. | 在水中加入氯化铝固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应热就是反应发出的热量 | |
| B. | 由C(s)+$\frac{1}{2}$O2(g)═CO(g)的反应热为110.5kJ•mol-1,可知碳的燃烧热为110.5 kJ•mol-1 | |
| C. | 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 | |
| D. | 1mol NaOH分别和1mol CH3COOH、1mol HNO3反应放出的热量:CH3COOH<HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
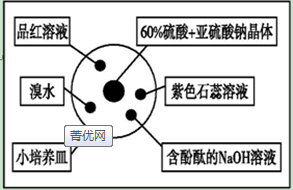
| A. | 品红溶液褪色 | B. | 溴水橙色褪去 | ||
| C. | 含酚酞的NaOH溶液红色变浅 | D. | 紫色石蕊溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 NaCl | B. | 0.1mol•L-1 NH4NO3 | ||
| C. | 0.1mol•L-1NaOH | D. | 0.1mol•L-1Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl只代表一种物质 | B. | CH2Cl2只代表一种物质 | ||
| C. | CHCl3只代表一种物质 | D. | CCl4和CH4的结构相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com