
| A. | 铝元素是地壳中含量最多的元素 | |
| B. | 工业炼铝采用电解熔融的铝土矿的方法 | |
| C. | 冰晶石能使氧化铝熔融温度降低 | |
| D. | 工业上可用电解熔融氯化铝制取金属铝 |
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用lmol的醋酸溶液和1.01mol的氢氧化钠溶液做中和热实验测得中和热的数值为57.3kJ/mol | |
| B. | 用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.7mL | |
| C. | 室温下,用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 通过实验得知在常温常压下,12g固体C和32g气体O2所具有的总能量一定大于44g气体CO2所具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的硝酸跟pH=11的氢氧化钡溶液 | |
| B. | pH=3的盐酸跟pH=11的氨水 | |
| C. | pH=3硫酸跟pH=11的氢氧化钠溶液 | |
| D. | pH=3的醋酸跟pH=11的氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1 Na2CO3溶液:2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 | |
| D. | 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,c(NH4+)的大小关系:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe与足量氯气充分反应时转移的电子数为2NA | |
| B. | 18 g水中所含的电子数为10NA | |
| C. | 0.3 mol•L-1Na2SO4溶液中含0.6NA个Na+ | |
| D. | 11.2 L氮气中含NA个氮原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
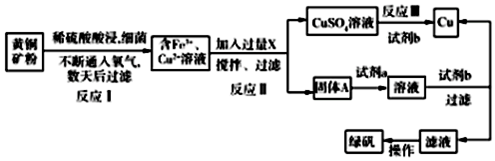
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com