

 ��
��
���� ��1����NH3���ڹ��ۻ�������������Ӽ��������д���3�Թ��õ��Ӷԣ���ԭ�������Ϊ8�����ӣ�
������Һ�����ķ�ӦΪNH4HS��������Ӧ�������ʺ�һˮ�ϰ������ԭ���غ�͵����غ���ƽ��д��ѧ����ʽ��
��2����ͼ��ֱ�д���Ȼ�ѧ����ʽ����ϸ�˹���ɼ���õ���ӦCO2��g��+CH4��g��?2CO��g��+2H2��g�����Ȼ�ѧ����ʽ��
��3��CO2��g��+CH4��g��?2CO��g��+2H2��g����Ӧ�������������ķ�Ӧ��
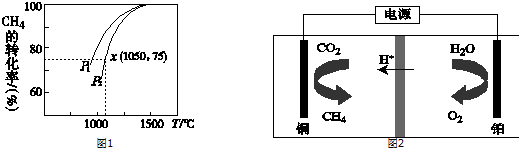
���¶�һ����ͼ�������֪P1��P2ѹǿ�¼���ת����P1��˵��P1��P2��
��ͼ��1050��Cʱ����ת����75%�������ʱ��ƽ��Ũ�ȣ�1050��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$��
��4�����������������ж�ͭ�缫Ϊ������������̼�õ��������ɼ��飬���缫Ϊ����������������ʧ��������������
��� �⣺��1����NH3���ڹ��ۻ�������������Ӽ��������д���3�Թ��õ��Ӷԣ���ԭ�������Ϊ8�����ӣ������ĵ���ʽΪ ��
��
�ʴ�Ϊ�� ��
��
������Һ�����ķ�ӦΪNH4HS��������Ӧ�������ʺ�һˮ�ϰ�����Ӧ�Ļ�ѧ����ʽΪ��2NH4HS+O2=2NH3•H2O+2S����
�ʴ�Ϊ��2NH4HS+O2=2NH3•H2O+2S����
��2����CH4��g��+2O2��g��=CO2 ��g��+2H2O��l����H=-890.3KJ/mol��
��N2��g��+O2��g��=2NO��g����H=+180KJ/mol
��˹���ɼ����-�ڡ�2�õ�CH4��g��+4NO��g��=2N2��g��+CO2 ��g��+2H2O��l����H=-1250.3kJ•mol-1 ��
�ʴ�Ϊ��CH4��g��+4NO��g��=2N2��g��+CO2 ��g��+2H2O��l����H=-1250.3kJ•mol-1 ��
��3����CO2��g��+CH4��g��?2CO��g��+2H2��g����Ӧ�������������ķ�Ӧ���÷�Ӧ��Сѹǿ��ƽ�������ƶ�����ͼ��֪���¶�һ��ʱ��P1��CH4��ת���ʽϴ�P1��P2��
�ʴ�Ϊ��С�ڣ��÷�Ӧ��Сѹǿ��ƽ�������ƶ�����ͼ��֪���¶�һ��ʱ��P1��CH4��ת���ʽϴ�����P1��P2��
��ͼ��1050��Cʱ����ת����75%��������м�����ʽ���㣬
CO2��g��+CH4��g��?2CO��g��+2H2��g��
��ʼ����mol/L�� 1 1 0 0
�仯����mol/L�� 0.75 0.75 1.5 1.5
ƽ������mol/L�� 0.25 0.25 1.5 1.5
K=$\frac{1��{5}^{2}��1��{5}^{2}}{0.25��0.25}$=81��
�ʴ�Ϊ��81��
��4�����������������ж�ͭ�缫Ϊ������������̼�õ��������ɼ��飬���缫Ϊ����������������ʧ��������������ͭ�缫�Ϸ�ɽ�ĵ缫��ӦΪ��CO2+8e-+8H+=CH4+2H2O��
�ʴ�Ϊ��CO2+8e-+8H+=CH4+2H2O��
���� ���⿼�������ʽṹ���Ȼ�ѧ����ʽ��д��˹���ɵļ���Ӧ�ã�ͼ���������ѧƽ��Ӱ�����ء�ƽ�ⳣ���ļ����֪ʶ�㣬���ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���NaCl������Һ�����Ƶý����� | |
| B�� | �ں������������п�飬�ɼ�������ĸ�ʴ���� | |
| C�� | Ѱ�Ҹ�Ч����������̫���ֽܷ�ˮ����ȡ�����Ľ����뷽�� | |
| D�� | MgO���۵�ܸߣ��������������²��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ɫ���ٸı� | B�� | ���������ܶȲ��ٸı� | ||
| C�� | ��������ѹǿ���ٸı� | D�� | ��������ƽ�������������ٸı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �ֱ��ʾN2��H2��NH3������������ڹ����������ϳɰ��Ĺ��̿�����ͼ4��ʾ��
�ֱ��ʾN2��H2��NH3������������ڹ����������ϳɰ��Ĺ��̿�����ͼ4��ʾ��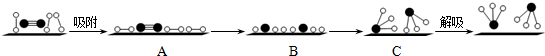
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��һ�������£���������������������·�Ӧ��2SO2��g��+O2��g��?2SO3��g������H��0��
��һ�������£���������������������·�Ӧ��2SO2��g��+O2��g��?2SO3��g������H��0���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
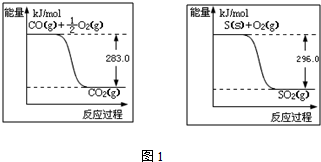
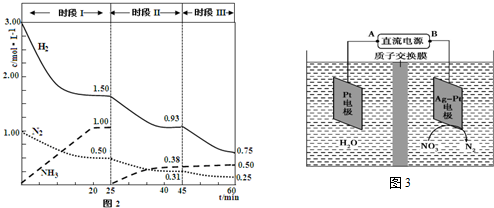
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
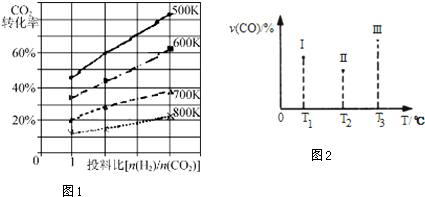
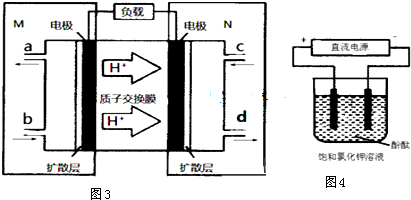
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��B2-��+c��HB-��=0.1 mol/L | B�� | c��B2-��+c��HB-��+c��H2B��=0.1 mol/L | ||
| C�� | c��OH-��=c��H+��+c��HB-��+2c��H2B�� | D�� | c��Na+��+c��OH-��=c��H+��+c��HB-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com