
| A. | .m+n>p△H>0 | B. | m+n<p△H>0 | C. | .m+n>p△H<0 | D. | m+n<p△H<0 |
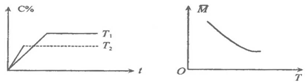
分析 根据“先拐先平数值大”知,左图中T2>T1,升高温度C的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应;
根据右图知,升高温度,平衡向逆反应方向移动,平均相对分子质量减小,因为反应前后质量不变,则说明逆反应方向为气体体积增大的方向,据此分析解答.
解答 解:根据“先拐先平数值大”知,左图中T2>T1,升高温度C的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应,所以△H<0;
根据右图知,升高温度,平衡向逆反应方向移动,平均相对分子质量减小,因为反应前后质量不变,则说明逆反应方向为气体体积增大的方向应,则m+n>p;
故选C.
点评 本题考查可逆反应中温度对化学平衡影响图象分析,采用“先拐先平数值大”原则分析即可,同时考查学生分析问题能力,题目难度不大.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 化学变化过程是原子的重新组合过程 | |
| C. | 生成物总能量高于反应物总能量的反应是吸热反应 | |
| D. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
将 浓度为0.1 mol·L-1 HF
浓度为0.1 mol·L-1 HF 溶液加水不断稀释,下列各
溶液加水不断稀释,下列各 量始终保持增大的是( )
量始终保持增大的是( )
A.c(H+) B.Ka(HF)
C.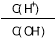 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/°C | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | △H>0 | |
| B. | 1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5mol、1.8mol,此时反应向正反应方向进行 | |
| C. | 其他条件不变,向平衡体系充入CO2气体,K值减小 | |
| D. | 其他条件不变,升高温度,可以提高CO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:实验题
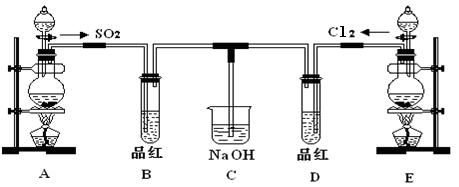
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
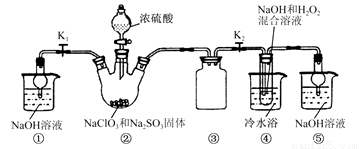
(1) 装置②中产生ClO2气体的化学方程式为 ;
装置④中制备NaClO2的化学方程式为 。
(2) 装置③的作用是 。
(3) 从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60 ℃干燥,得到成品。
实验II. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2?+4I?+4H+==2H2O+2I2+Cl?);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L?1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32?=2I?+S4O62?)。
(4) 达到滴定终点时的现象为 。
(5) 该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6) 在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com