
【题目】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。请回答:
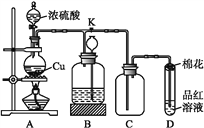
(1)装置A中发生反应的化学方程式为_______________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中长颈漏斗内液面上升,广口瓶内液面下降,则B中应放置的液体是(填字母)___。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和V L 18 mol·L-1硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是__(填字母)。
A.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
③实验结束时测得铜减少了3.2 g,则被还原的硫酸的物质的量为_____mol;转移的电子为_____mol;反应后溶液中硫酸根离子的物质的量浓度为_________mol·L-1。(反应后溶液的体积为V L)
【答案】 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 碱液 d 随着反应的进行,浓硫酸变为稀硫酸,而铜不能与稀硫酸反应 ad 0.05 0.1 (18V-0.05)/V
CuSO4+SO2↑+2H2O 碱液 d 随着反应的进行,浓硫酸变为稀硫酸,而铜不能与稀硫酸反应 ad 0.05 0.1 (18V-0.05)/V
【解析】(1)加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。(2)二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱液吸收,所以棉花蘸取的溶液可以为NaOH溶液等碱性溶液;其作用是吸收多余的二氧化硫,防止二氧化硫溢出而污染大气。(3)当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,导致B中气体压强增大,气压使B中液体通过长颈漏斗液面上升,从而减小压强,防止安全事故发生,此时B中现象是瓶中液面下降,长颈漏斗中液面上升;B装置的作用是贮存气体,所以B中盛放液体不能和二氧化硫反应,水、酸性高锰酸钾及浓硝酸都能和二氧化硫反应,只有亚硫酸氢钠和二氧化硫不反应,答案选d;(4)①一定质量的铜片和一定体积18molL-1的浓硫酸放在圆底烧瓶中共热,浓硫酸随着反应进行,浓度变小成为稀硫酸,稀硫酸不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解;②能用来证明反应结束后的烧瓶中确有余酸,实质证明氢离子的存在,a.铁粉与稀硫酸反应放气体,可以证明稀硫酸有剩余,a正确;b.BaCl2溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,故不能证明稀硫酸有剩余,b错误;c.银粉不与稀硫酸反应,不能证明稀硫酸有剩余,c错误;d.Na2CO3溶液会与稀硫酸反应放出二氧化碳气体,可以证明稀硫酸有剩余,d正确;答案选ad;③实验结束时测得铜减少了3.2 g,物质的量是0.05mol,根据方程式可知被还原的硫酸的物质的量为0.05mol;铜元素化合价从0价升高到+2价,转移的电子为0.05mol×2=0.1mol;生成二氧化硫是0.05mol,硫酸的物质的量是18Vmol,根据硫原子守恒可知反应后硫酸根的物质的量是18Vmol-0.05mol,所以反应后溶液中硫酸根离子的物质的量浓度为(18V-0.05)/V mol·L-1。
CuSO4+SO2↑+2H2O。(2)二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱液吸收,所以棉花蘸取的溶液可以为NaOH溶液等碱性溶液;其作用是吸收多余的二氧化硫,防止二氧化硫溢出而污染大气。(3)当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,导致B中气体压强增大,气压使B中液体通过长颈漏斗液面上升,从而减小压强,防止安全事故发生,此时B中现象是瓶中液面下降,长颈漏斗中液面上升;B装置的作用是贮存气体,所以B中盛放液体不能和二氧化硫反应,水、酸性高锰酸钾及浓硝酸都能和二氧化硫反应,只有亚硫酸氢钠和二氧化硫不反应,答案选d;(4)①一定质量的铜片和一定体积18molL-1的浓硫酸放在圆底烧瓶中共热,浓硫酸随着反应进行,浓度变小成为稀硫酸,稀硫酸不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解;②能用来证明反应结束后的烧瓶中确有余酸,实质证明氢离子的存在,a.铁粉与稀硫酸反应放气体,可以证明稀硫酸有剩余,a正确;b.BaCl2溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,故不能证明稀硫酸有剩余,b错误;c.银粉不与稀硫酸反应,不能证明稀硫酸有剩余,c错误;d.Na2CO3溶液会与稀硫酸反应放出二氧化碳气体,可以证明稀硫酸有剩余,d正确;答案选ad;③实验结束时测得铜减少了3.2 g,物质的量是0.05mol,根据方程式可知被还原的硫酸的物质的量为0.05mol;铜元素化合价从0价升高到+2价,转移的电子为0.05mol×2=0.1mol;生成二氧化硫是0.05mol,硫酸的物质的量是18Vmol,根据硫原子守恒可知反应后硫酸根的物质的量是18Vmol-0.05mol,所以反应后溶液中硫酸根离子的物质的量浓度为(18V-0.05)/V mol·L-1。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存,加入OH﹣有沉淀析出,加入H+能放出气体的是( )
A.Na+、C1﹣、NO ![]() 、H+?
、H+?
B.K+、Cl﹣、SO ![]() 、H
、H
C.Fe3+、C1﹣、SO ![]() 、NH
、NH ![]()
D.Ca2+、HCO ![]() 、Cl﹣、NO
、Cl﹣、NO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验SO42-,甲、乙、丙、丁四位同学设计了如下四种方案,其中方案最优的是( )
A. 方案甲:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B. 方案乙:试液![]() 白色沉淀
白色沉淀![]() 沉淀不溶解
沉淀不溶解
C. 方案丙:试液![]() 白色沉淀
白色沉淀![]() 沉淀不溶解
沉淀不溶解
D. 方案丁:试液![]() 无沉淀(也无气泡)
无沉淀(也无气泡)![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列结论均出自《实验化学》中的实验,其中错误的是( )
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据
C.镀锌铁皮发生电化学腐蚀时,锌发生氧化反应
D.食醋的总酸含量是指食醋中醋酸的总物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H为八种相邻的短周期元素,其单质的沸点如图所示.
请回答:
①上述元素中,某些元素与氢元素形成的含有十个电子的阳离子中含有配位键,请写出其离子、(填化学式).
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的电负性由大到小的顺序为(用相关元素符号表示) . F、G、H三种元素的第一电离能由大到小的顺序为(用相关元素符号表示) .
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华.据此推测该化合物的化学键类型为 . 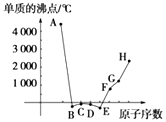
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X,Y,Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
①2H2(g)+CO(g)CH3OH (g)△H=﹣90.8kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.3kJmol﹣1
(1)总合成反应的热化学方程式为 .
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是(填字母代号).
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度
E.分离出二甲醚
(3)已知反应②2CH3OH(g)CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表格:
物质 | CH3OH | CH3OCH3 | H2O |
c/molL﹣1 | 0.44 | 0.60 | 0.60 |
此时,v(正)v(逆) 填“>”、“<”或“=”);达到平衡后,CH3OCH3的物质的量浓度是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com