
| A. | 氨水 | B. | NaNO3溶液 | C. | 盐酸 | D. | Na2CO3溶液 |
分析 常温下,0.10mol/L的下列溶液中呈中性,说明溶液中C(H+)=c(OH-)=10-7mol/L,
解答 解:A.氨水是一水合氨水溶液,一水合氨电离出氢氧根离子,溶液显碱性,PH>7,故A错误;
B.NaNO3溶液中硝酸钠是强酸强碱盐溶液呈中性,溶液中C(H+)=c(OH-)=10-7mol/L,故B正确;
C.盐酸是强酸完全电离溶液显酸性,PH<7,故C错误;
D.Na2CO3溶液中溶质是强碱弱酸盐,碳酸根离子水解溶液显碱性,PH>7,故D错误;
故选B.
点评 本题考查了溶液酸碱性的分析判断,主要是中性溶液的判断依据是溶液中C(H+)=c(OH-)=10-7mol/L,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 氢有三种同位素,即有三种氢原子 | |
| B. | 所有元素的原子核均由质子和中子构成 | |
| C. | 具有相同核外电子数的粒子总称为元素 | |
| D. | 相对原子质量相同的原子是同一种元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>H2S | B. | 原子半径:Na>Mg | ||
| C. | 酸性:H3PO4>H2SO4 | D. | 还原性:I->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠、碳化钙着火时,可直接用高压水枪喷火扑灭 | |
| B. | 去除银器表面的Ag2S,可将银器放在盛有食醋的铝锅中煮沸 | |
| C. | 苹果在空气中久置变黄和纸张变黄的原理相似 | |
| D. | 用乙醚从黄花蒿中萃取青蒿素发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:| 编号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解 的时间/s |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 细小颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
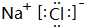 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com