
| A. | 1mol Cl2与足量Fe反应,转移的电子数为2nA | |
| B. | 19.2g纯铜理论上可以制得纯净的硝酸铜的物质的量为0.3NA | |
| C. | 1.8 gAl与足量的盐酸反应放出的氢气为0.1NA | |
| D. | 0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA |
分析 A、氯气和铁反应后变为-1价;
B、求出铜的物质的量,然后根据1mol铜反应后生成1mol硝酸铜;
C、求出铝的物质的量,然后根据1mol铝反应生成1.5mol氢气;
D、3mol铁和水蒸汽反应生成4mol氢气.
解答 解:A、氯气和铁反应后变为-1价,故1mol氯气反应后转移2mol电子即2nA个,故A正确;
B、19.2g铜的物质的量为n=$\frac{19.2g}{64g/mol}$=0.3mol,而1mol铜反应后生成1mol硝酸铜,故生成0.3mol硝酸铜,故B正确;
C、1.8g铝的物质的量为$\frac{2}{30}$mol,而1mol铝反应生成1.5mol氢气,故$\frac{2}{30}$mol铝生成0.1mol氢气即0.1NA个,故C正确;
D、3mol铁和水蒸汽反应生成4mol氢气,故0.1mol铁反应生成$\frac{4}{30}$mol氢气即$\frac{4}{30}$NA个氢气分子,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.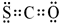 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -488.3 kJ/mol | B. | -244.15 kJ/mol | C. | 488.3 kJ/mol | D. | 244.15 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | NH4HCO3溶液与少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| C. | 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ab}{22400}$mol•L-1 | B. | $\frac{ab}{22400+17a}$mol•L-1 | ||
| C. | $\frac{1000ab}{22400+35a}$mol•L-1 | D. | $\frac{1000ab}{22400+17a}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Cl-、AlO2- | B. | SO42-、NO3-、Fe2+、Al3+ | ||
| C. | Cl-、SO32-、Na+、K+ | D. | Na+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
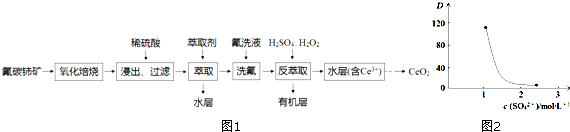
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
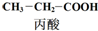 $→_{①}^{Cl_{2},红磷}$
$→_{①}^{Cl_{2},红磷}$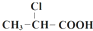 $→_{②}^{一定条件}$
$→_{②}^{一定条件}$ 下列说法正确的是( )
下列说法正确的是( )| A. | 步骤①、②分别是加成反应、取代反应 | B. | 蛋白质水解也可生成乳酸 | ||
| C. | 丙酸烃基上的二氯代物有2种 | D. | 乳酸与丙烯完全燃烧的产物相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com