
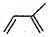
 )是合成天然橡胶的单体.请回答下列问题:
)是合成天然橡胶的单体.请回答下列问题: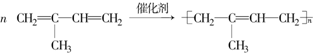 ,该反应类型为加聚反应.
,该反应类型为加聚反应.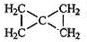 .
. 分析 (1)主链为含有2个碳碳双键的最长碳链,甲基的位置为2号C;
(2)A和溴为等物质的量时,可能加成在1、2号碳原子上,也可能加成在3、4号碳原子上,也可能发生1、4加成;
(3)2-甲基-1,3-丁二烯发生加聚反应生成聚2-甲基-1,3-丁二烯;
(4)B的一氯化物只有一种(不考虑立体异构),说明等效氢的种类数是一种.
解答 解:(1)主链为含有2个碳碳双键的最长碳链,编号从靠近甲基的一端开始,甲基的位置为2号C,该有机物的化学名称是2-甲基-1,3-丁二烯,
故答案为:2-甲基-1,3-丁二烯;
(2)化合物A与溴的四氯化碳溶液反应,但A和溴为等物质的量时,可能加成在1、2号碳原子上,也可能加成在3、4号碳原子上,也可能发生1、4加成,因此生成的产物有3种,
故答案为:3;
(3)2-甲基-1,3-丁二烯发生加聚反应生成聚2-甲基-1,3-丁二烯,化学反应方程式为 ,
,
故答案为: ;加聚反应;
;加聚反应;
(4)B是A的一种同分异构体,分子式也是C5H8,B的一氯化物只有一种(不考虑立体异构),说明8个氢原子全部等效,则B的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的命名、结构与性质的关系、有机反应类型、同分异构体、有机反应方程式书写等,综合性较强,为高频考点,难度中等,掌握有机物结构和性质是解题关键.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:高中化学 来源: 题型:填空题
 在“天宫二号”上蚕宝宝的“太空屋”形似胶囊(如图),两端的半球体由航天铝合金打造,中间部分采用透明有机玻璃,蚕宝宝由聚氨酯海绵包裹着.
在“天宫二号”上蚕宝宝的“太空屋”形似胶囊(如图),两端的半球体由航天铝合金打造,中间部分采用透明有机玻璃,蚕宝宝由聚氨酯海绵包裹着.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1 mol•L-1硫酸中所含的氧原子数为4NA | |
| B. | 标准状况下,11.2LCCl4所含的原子数为2.5NA | |
| C. | 2.3gNa中所含的电子数为1.1NA | |
| D. | 常温常压下,14g由N2与CO组成对混合气体中所含对原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH不可能是7 | B. | 该溶液的pH一定是4 | ||
| C. | 该溶液的pH一定是10 | D. | 不会有这样的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的平均反应速率为0.15mol•L-1•min-1 | |
| B. | 恒温下达到平衡的标志是C和A的生成速率相等 | |
| C. | 降低平衡体系的温度,逆反应速率变小,正反应速率增大 | |
| D. | B的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
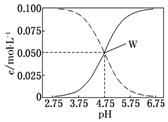 常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )| A. | pH=5.75的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=7,c(Na+)=0.1 mol•L-1,c( CH3COOH)>c(Na+)=c( CH3COO-)>c(H+)=c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com