
 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按框图进行反应.又知D溶液为黄色,E溶液是无色的,请回答:
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按框图进行反应.又知D溶液为黄色,E溶液是无色的,请回答: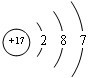 ,
, ;
;| 0.075mol |
| 12mol/L |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、以上反应是可逆反应 |
| B、放电时,镉为正极 |
| C、放电时负极附近溶液的pH不变 |
| D、充电时阳极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将待过滤的物质搅拌后直接倒入过滤器中 |
| B、将待过滤的物质静置后先倒出上层清液,再将沉淀倒入过滤器中 |
| C、将待过滤的物质静置后直接倒入过滤器中 |
| D、将待过滤的物质沿着玻璃棒倒入过滤器中,玻璃棒下端应靠在三层滤纸处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
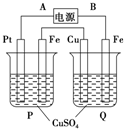 在如图装置中,通电后可观察到Cu极溶解,则下列说法中不正确的是( )
在如图装置中,通电后可观察到Cu极溶解,则下列说法中不正确的是( )| A、直流电源中,A是正极 |
| B、两池内CuSO4溶液浓度均不改变 |
| C、两池中的铁电极上最初析出物质相同 |
| D、P池内溶液的质量逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等体积、等物质的量浓度的明矾溶液和Ba(OH)2溶液混合:3Ba2++6OH -+2Al3++3SO42-═2Al(OH)3↓+3BaSO4↓ |
| B、FeSO4酸性溶液暴露在空气中:4Fe2++O2+2H2O=4Fe3++4OH - |
| C、向AlCl3溶液中投入过量Na:2Al3++6Na+6H2O=2Al(OH)3↓+6Na++3H2↑ |
| D、向FeBr2 溶液中通入少量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属单质在反应中只能作还原剂,非金属单质只能作氧化剂 |
| B、失电子多的金属还原性强 |
| C、某元素从化合态到游离态,该元素一定被还原 |
| D、氧化还原反应中一定存在电子的转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com