


科目:高中化学 来源:不详 题型:单选题
| A.(Q1+Q2+Q3) kJ | B.[0.5(Q1+Q2+Q3)] kJ |
| C.(0.5Q1-1.5Q2+0.5Q3) kJ | D.(1.5Q1-0.5Q2+0.5Q3) kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1 CH3CH2OH(g)+3H2O(g) △H =" —173.6" kJ·mol-1
CH3CH2OH(g)+3H2O(g) △H =" —173.6" kJ·mol-1 2CH3OH的热化学方程式为:__________________。
2CH3OH的热化学方程式为:__________________。

 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,若催化剂的表面积S1>S2 ,在上图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,若催化剂的表面积S1>S2 ,在上图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2 O2(g)===H2O(g) △H ="-241.8" kJ·mol-1
O2(g)===H2O(g) △H ="-241.8" kJ·mol-1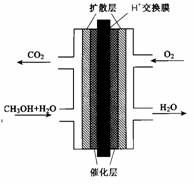
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
CO2(g) + H2(g) △H1=" +" 41.2kJ/mol CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
CO2(g) + H2(g) △H1=" +" 41.2kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K
H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K 2NH3(g)的K′=0.5。
2NH3(g)的K′=0.5。 N2(g)+3H2(g)的K=__________(填数值)。
N2(g)+3H2(g)的K=__________(填数值)。查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.热裂解形成燃油 | B.露天焚烧 |
| C.作为有机复合建筑材料的原料 | D.直接填埋 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com