
向20mL0.5mol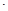 L
L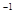 的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是
的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是
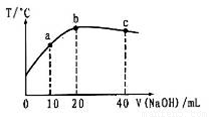
A.醋酸的电离平衡常数:b点>a点
B.由水电离出的c(OH-):b点>a点
C.从a点到b点,混合溶液中可能存在:c(Na+)=c(CH3COO-)
D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D
【解析】
试题分析:A、醋酸是弱电解质,在水溶液里存在电离平衡,且其电离过程吸热,温度越高,醋酸的电离程度越大,其电离常数越大,故A正确;B、b点酸碱恰好反应生成醋酸钠,c点氢氧化钠过量,氢氧化钠是强碱抑制水电离,醋酸钠水解促进水电离,所以由水电离出的c(OH-):b点>a点,故B正确;C、如果 c(Na+)=c(CH3COO-),根据电荷守恒知,溶液中c(OH-)=c(H+),醋酸钠是强碱弱酸盐,水解水溶液呈碱性,因此要使其溶液呈中性,则醋酸应该稍微过量,所以从a点到b点,混合溶液中可能存在:c(Na+)=c(CH3COO-),故C正确;D、从b点到c点,氢氧化钠过量,溶液中的溶质是醋酸钠和氢氧化钠,当氢氧化钠的物质的量大于醋酸钠的物质的量时,混合溶液中存在:c(Na+) c(OH-)>>c(CH3COO-)>c(H+),故D错误,答案选D。
考点:考查外界条件对电离平衡常数以及水电离的影响;酸碱中和时溶液酸碱性以及溶液中离子浓度大小比较等


科目:高中化学 来源: 题型:
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?武汉模拟)常温下,向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )
(2013?武汉模拟)常温下,向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 已知某温度下,CH3COOH的电离平衡常数K=1.6×10-5.该温度下向20mL0.01mol/L CH3COOH溶液中逐滴加入0.01mol/L KOH溶液,溶液pH变化的曲线如图所示(忽略温度变化).
已知某温度下,CH3COOH的电离平衡常数K=1.6×10-5.该温度下向20mL0.01mol/L CH3COOH溶液中逐滴加入0.01mol/L KOH溶液,溶液pH变化的曲线如图所示(忽略温度变化).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离过程的热化学方程式可表示为:H2O(l)?H+(aq)+OH-(aq)△H=(a-b)KJ/mol | B、当滴入10mL盐酸时,溶液中:c(NH4+)+c(NH3?H2O)=2c(Cl-) | C、随着盐酸的逐滴加入,水电离的c(OH-)总是逐渐减小 | D、当滴入20 mL盐酸时,溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com