
【题目】空气是一种宝贵的自然资源,下列有关说法正确的是( )
A.稀有气体约占空气质量的0.03%
B.空气质量指数级别越大,空气质量越好
C.氮气常温下化学性质稳定,可用于生产氮肥
D.氦气可用于填充探空气球
科目:高中化学 来源: 题型:
【题目】下列事实,能用勒夏特列原理解释的是( )
A. H2、I2、HI平衡混和气加压后颜色变深 B. 实验室中常用排饱和食盐水的方法收集Cl2
C. 合成氨控制在500 ℃左右的温度 D. SO2催化氧化成SO3的反应,往往需要使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。空气吹出SO2吸收法工艺流程如下:

(1)步骤③的离子方程式: _________________________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 实验操作 | 实验现象 |
① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液。 | 试管A、B中均未明显见到有气泡产生。 |
(1)实验①的目的是___________________________________________,实验中滴加FeCl3溶液的目的是________________________________。
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是________________________________________________________(用实验中所提供的几种试剂)。
(3)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图甲所示,则A、B、C三点所表示的瞬时反应速率最慢的是_____________。
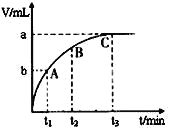
甲 乙 丙
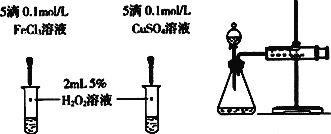
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图乙、丙所示的实验。请回答相关问题:
①定性如图乙可通过观察_________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______________________________________。
②定量用图丙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是______________________________。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________方法的应用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应:A+B![]() C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是

A. A、B、C是气体,D不是气体
B. A、B是气体,C、D有一种是气体
C. C、D是气体,A、B有一种是气体
D. C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,向0.1mol·L-1的醋酸溶液中加水稀释,溶液中c(H+)/c(CH3COOH)减小
B. 反应N2(g)+3H2(g) ![]() 2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
C. 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
D. 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H= - 890.0kJ/mol
(2)2C2H6(g)+7O2(g)==4CO2(g)+6H2O(l) △H= - 3119.6kJ/mol
(3)C2H4(g)+3O2(g)==2CO2(g)+2H2O(l) △H= - 1411.0kJ/mol
(4)2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) △H= - 2599.2kJ/mol
(5)C3H8(g)+5O2(g)==3CO2(g)+4H2O(l) △H= - 2219.9kJ/mol
现有由上述五种烃中的两种组合成的混合气体2mol,经充分燃烧后放出2970.8kJ热量,则下列哪些组合是不可能的 ( )
A. CH4和C3H8 B. C2H4和C3H8 C. C2H6和C3H8 D. C2H6和CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中![]() =________。
=________。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=________。该温度________(填“高于”或“低于”)25 ℃。
(3)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则![]() =________。
=________。
(4)常温下,pH=13的Ba(OH)2溶液a L与pH=3的H2SO4溶液b L混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a∶b=________。
若所得混合溶液pH=12,则a∶b=________。
(5)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=________。
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com