
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫的排放会导致光化学烟雾的产生 | |
| C. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| D. | 硫粉在过量的纯氧中燃烧也不能生成三氧化硫 |
分析 A.火山口存在游离态的硫;
B.二氧化硫与酸雨有关;
C.发生复分解反应生成亚硫酸钠;
D.硫燃烧反应生成二氧化硫.
解答 解:A.自然界中存在游离态的硫,如火山口存在游离态的硫,故A错误;
B.排放二氧化硫会污染空气,形成酸雨,但不会导致光化学烟雾产生,导致光化学烟雾的产生的是氮氧化物,故B错误;
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了酸性氧化物的性质,与漂白性无关,故C错误;
D.硫粉燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,故D正确;
故选D.
点评 本题考查含硫物质的性质,侧重二氧化硫性质的考查,注意性质与现象、用途的关系即可解答,注重基础知识的训练,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 体积比1:1 | B. | 体积比11:16 | C. | 分子个数比1:1 | D. | 密度比11:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L乙酸溶液中 H+数为0.1NA | |
| B. | 16g甲烷分子中所含质子数为10NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1nNA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
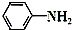 +CH3COOH$\stackrel{△}{→}$
+CH3COOH$\stackrel{△}{→}$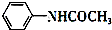 +H2O
+H2O| 试剂名称 | 熔点℃ | 沸点℃ | 溶解度(20℃) |
| 苯胺 | -6.2 | 184.4 | 稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 | 16.7 | 118 | 易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 114~116 | 280~290 | 0.46g |
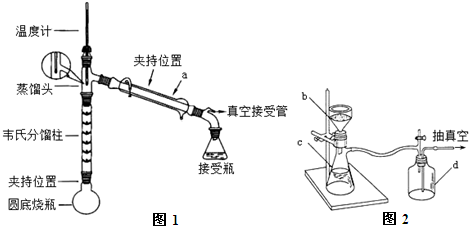
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量的NaOH固体,Na2S溶液中的c(Na+)、c(S2-)均增大 | |
| B. | Na2S溶液中存在着:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | Na2S溶液中离子浓度关系为:c(Na+)>c(OH-)>c(S2-)>c(H+) | |
| D. | Na2S溶液中存在着:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{V•d}{MV+2240}$mol/L | B. | $\frac{M•V}{2240(V+0.1)d}$mol/L | ||
| C. | $\frac{100V•d•M}{MV+2240}$mol/L | D. | $\frac{1000V•d}{MV+2240}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com