(2012?许昌三模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去).
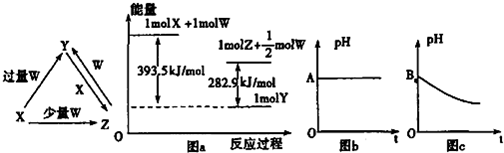
(1)若X为金属单质,W是某强酸的稀溶液,则Z和W反应生成Y的离子方程式为
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
.
(2)若X为非金属单质,W是空气的主要成分之一.它们之间转化时能量变化如上图a,请写出X+W→Z的热化学方程式:
C(s)+
O
2(g)=CO(g)△H=-110.6kJ?mol
-1C(s)+
O
2(g)=CO(g)△H=-110.6kJ?mol
-1.
(3)若X、Y为盐,W为强碱,X的水溶液显酸性,则反应Z+W→Y的离子方程式为
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.
(4)若X为强碱,W为气态氧化物.常温时,将Y的水溶液露置于空气中,其pH随时间t变化可能如图的图b或图c所示(不考虑W的溶解和水的挥发).
①若图b符合事实,则W为
CO2
CO2
(填化学式),此时图b中A
>
>
7(填“>”“<”“=”)
②若图c符合事实,则其pH变化的原因是
2HSO3-+O2=2H++2SO42-
2HSO3-+O2=2H++2SO42-
(用离子方程式表示);已知图c中B<7,Y的焰色反应为黄色,则Y溶液中各离子浓度由大到小的顺序是
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
.




 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案