
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.55 mol?L-1 NaOH溶液 | 50 mL 0.5 mol?L-1 HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50 mL 0.55 mol?L-1 NaOH溶液 | 50 mL 0.5 mol?L-1 HCl溶液 | 20℃ | 23.5℃ | |
| Q |
| n |
| 1.4212KJ×1mol |
| 0.025mol |


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
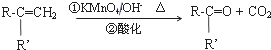
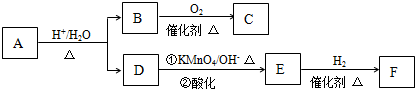
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
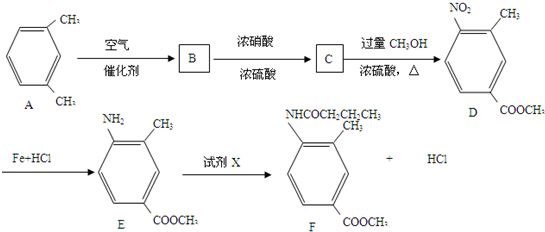
 制备化合物
制备化合物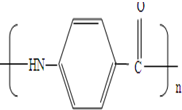
查看答案和解析>>
科目:高中化学 来源: 题型:
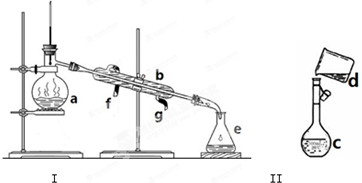 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题:
如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | |
| A | - | ↓ | ↓ | ↓ | - |
| B | ↓ | - | - | ↑ | ↓ |
| C | ↓ | - | - | ↑ | - |
| D | ↓ | ↑ | ↑ | - | ↓ |
| E | - | ↓ | - | ↓ | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com