
分析 (1)根据M=ρVm可知,相同条件下气体密度与摩尔质量成正比;两个容器中气体密度相等,则含有的气体的质量相同,容器中压强与气体的物质的量成正比;
(2)根据ρ=$\frac{m}{V}$计算混合气体的密度,令CO和CO2的物质的量分别为xmol、ymol,根据二者质量及体积列方程计算解答.
解答 解:(1)相同条件下,M、N气体的密度之比与其摩尔质量成正比,所以二者的密度之比为:2:1,两个容器中气体的密度相同,则气体的质量相等,物质的量与摩尔质量成反比,而压强与气体的物质的量成正比,则容器中气体的压强与摩尔质量成反比,两个容器中压强之比为:2:1;1:2;
故答案为:2:1;1:2;
(2)混合气体的密度=$\frac{18g}{11.2L}$=1.6g/L,
令CO和CO2的物质的量分别为xmol、ymol,根据二者质量及体积,则:
$\left\{\begin{array}{l}{28x+44y=18}\\{x+y=\frac{11.2}{22.4}}\end{array}\right.$
解得x=0.25 y=0.25
原混合气体中,CO的质量是0.25mol×28g/mol=7g,
标况下,CO2的体积是0.25mol×22.4L/mol=5.6L,
故答案为:7;5.6L.
点评 本题考查混合物计算,侧重对物质的量有关计算考查,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
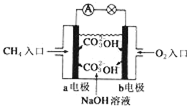 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ | |
| B. | 40mLlmol/LCH3COONa溶液与20mLlmol/LHCl溶液混合后溶液呈酸性,所得溶液中:c (CH3COO-)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的3.5倍 己知:Ksp[Cd(0H)2]=7.2×10-15,Ksp[Co(0H)2]=1.8×10-15 | |
| D. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:3 | B. | 3:4 | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②③④⑤ | C. | ②④⑤⑥⑦ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 丙炔 | C. | 丁二烯 | D. | 甲烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com