
分析 (1)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较pH,④Na2CO3和⑦NaHCO3,都是强碱弱酸盐,溶液显碱性,⑤KCl是强碱强酸盐溶液呈中性,⑥NH4Cl是强酸弱碱盐,溶液显酸性;
(2)溶液④为碳酸钠溶液,溶液中碳酸根离子分步水解,溶液显碱性;
(3)⑦为NaHCO3溶液,溶液中存在阳离子Na+、H+,阴离子为HCO3-、OH-、CO32-,电解质溶液呈中性,溶液中阴阳离子所带电荷数相同,据此书写电荷守恒;
(4)溶液⑦中的物料守恒是指溶液中存在的离子中,钠元素和碳元素守恒,n(Na+)=n(C),溶液体积相同,元素物质的量关系为浓度关系,碳元素所有存在形式的离子物质的量和钠离子物质的量相同;
(5)溶液⑥中的质子守恒是指水溶液中氯化铵水解显酸性,溶液中水电离出的氢离子和氢氧根离子相同,由于铵根离子水解,氢氧根离子存在形式变化为氢氧根离子和一水合氨,但水电离出的所有氢离子和氢氧根离子相同,据此写出质子守恒;
(6)浓度均为0.1mol/L的溶液①HCl和③Ba(OH)2按体积比1:2混合后,碱过量,计算反应后溶液中氢氧根离子浓度,用离子积常数换算出氢离子浓度,溶液PH=-lgc(H+);
(7)等体积等浓度的①HCl、②CH3COOH中,溶质物质的量相同,加入足量锌发生反应生成氢气相同;
(8)溶液①HCl浓度为0.1mol/L,溶液中由水电离出的c(H+)水=c(OH-)水=$\frac{Kw}{c({H}^{+})}$;
(9)已知25℃溶液⑥NH4Cl的pH=5,溶液中铵根离子水解显酸性,溶液中由水电离出的c(H+)=10-5mol/L.
解答 解:(1)盐酸和醋酸为酸,氢氧化钡为碱,碳酸钠、氯化钾、氯化铵和碳酸氢钠为盐,碳酸钠为强碱弱酸盐,其溶液呈碱性,氯化钾为强酸强碱盐,为中性,氯化铵为强酸弱碱盐,其溶液为酸性,碳酸氢钠溶液中碳酸氢根离子水解程度小于碳酸钠溶液中碳酸根离子水解程度,所以碳酸钠溶液碱性大于碳酸氢钠,相同浓度的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,所以pH盐酸小于醋酸,则这几种溶液的pH由小到大的顺序是①②⑥⑤⑦④③,
故答案为:①②⑥⑤⑦④③;
(2)溶液④为碳酸钠溶液,溶液中碳酸根离子分步水解,溶液显碱性,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(3)⑦为NaHCO3溶液,溶液中存在阳离子Na+、H+,阴离子为HCO3-、OH-、CO32-,电解质溶液呈中性,存在的电荷守恒为:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故答案为:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-);
(4)碳酸氢钠溶液中存在水解平衡和电离平衡,HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,溶液⑦中的物料守恒是指溶液中存在的离子中,钠元素和碳元素守恒,n(Na+)=n(C),溶液体积相同,元素物质的量关系为浓度关系,碳元素所有存在形式的离子物质的量和钠离子物质的量相同,溶液中存在的物料守恒为:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),
故答案为:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-);
(5)氯化铵水解显酸性,NH4++H2O?NH3•H2O+H+,溶液中水电离出的氢离子和氢氧根离子相同,由于铵根离子水解,氢氧根离子存在形式变化为氢氧根离子和一水合氨,溶液中的质子守恒为:c(H+)=c(NH3•H2O)+c(OH-),故答案为:c(H+)=c(NH3•H2O)+c(OH-);
(6)浓度均为0.1mol/L的溶液①HCl和③Ba(OH)2按体积比1:2混合后,碱过量,盐酸和氢氧化钡是强酸强碱,盐酸溶液中氢离子物质的量=0,1mol/L×1L=01mol,氢氧化钡溶液中氢氧根离子物质的量=0.1mol/L×2×2L=0.4mol,按照反应定量关系可知,H++OH-=H2O,剩余氢氧根离子物质的量为0.4mol-0.1mol=0.3mol,混合后计算反应后溶液中氢氧根离子浓度c(OH-)=$\frac{0.3mol}{3L}$=0.1mol/L,用离子积常数换算出氢离子浓度c(H+)=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,溶液PH=-lgc(H+)=13,
故答案为:13;
(7)等体积等浓度的①HCl、②CH3COOH中,溶质物质的量相同,都是一元酸,和足量锌反应得到氢气量相同,故答案为:=;
(8)溶液①HCl浓度为0.1mol/L,酸溶液中酸电离出的氢离子浓度c(H+)=0.1mol/L,溶液中由水电离出的c(H+)水=c(OH-)水=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,
故答案为:10-13;
(9)已知25℃溶液⑥NH4Cl的pH=5,溶液中铵根离子水解显酸性,NH4++H2O?NH3•H2O+H+,溶液中水电离出的氢氧根离子被铵根离子结合生成一水合氨,所以溶液中由水电离出的c(H+)=10-5mol/L,故答案为:10-5.
点评 本题考查了盐类水解原理,溶液PH大小比较和计算,离子浓度大小分析,溶液中电荷守恒、物料守恒、质子守恒的理解应用,水电离平衡中离子积常数的计算,题目综合性强涵盖知识丰富,题目难度中等.


科目:高中化学 来源: 题型:解答题
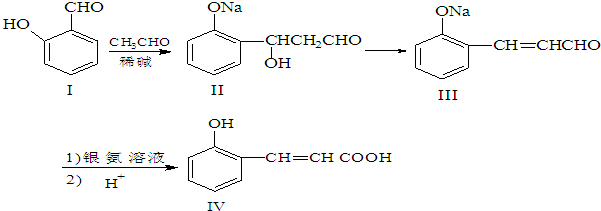
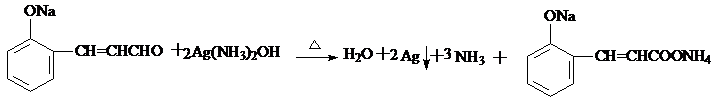 ;
;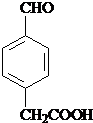 、
、
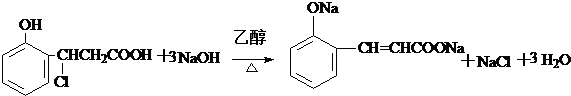 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80ml 0.1 mol•L-1NaCl溶液 | B. | 50ml 0.1 mol•L-1MgSO4溶液 | ||
| C. | 100ml 0.1 mol•L-1氨水 | D. | 0.1 mol固体氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,KW增大,pH不变 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,平衡向逆反应方向移动,c(H+)增大,KW不变 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装有干海带的坩埚置于泥三角上加热灼烧 | |
| B. | 加入过量的氯水确保I-被完全氧化 | |
| C. | 用四氯化碳溶液萃取碘单质,上层为水层可以弃去 | |
| D. | 可利用碘单质易升华的特性来提纯碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| B. | ①中水的电离程度最小,③中水的电离程度最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:④>③,①>② | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cl-、NO3- | B. | Ca2+、Cl-、CO32- | C. | K+、H+、HCO3- | D. | Cu2+、H+、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com