
【题目】下图为元素周期表的一部分,根据元素a~j在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | a | |||||||
2 | b | c | d | e | ||||
3 | f | g | h | i | j | |||
(1)在a ~j中,化学性质最不活泼的元素是___________(填元素符号)。
(2)f、g、h的单质分别与水反应,最剧烈的是___________(填元素符号)。
(3)c、i的氢化物稳定性较强的是____________(填化学式)。
(4)c、f可形成既含离子键又含非极性键的化合物,该化合物的电子式为__________。
(5)d、f、g的离子半径最大的是_______________(填离子符号)。
(6)f的最高价氧化物的水化物与h的最高价氧化物的水化物反应的离子方程式为:___________________________________。
【答案】NeNaH2O![]() F-Al(OH)3+OH-= AlO2-+2H2O
F-Al(OH)3+OH-= AlO2-+2H2O
【解析】
由元素在周期表中位置可知,a为H, b为N,c为O, d为F,e为Ne,f为 Na ,g为Mg, h 为 Al,i为 S,j为 Cl。
(1)在a ~j中,Ne为稀有气体元素,性质最稳定,因此化学性质最不活泼的元素是Ne,综上所述,本题答案是:Ne。
(2)金属性:Na>Mg>Al,所以,钠和冷水剧烈反应,镁、铝和冷水不反应;综上所述,本题答案是:Na。
(3)c、i的氢化物分别为H2O和H2S,同一主族元素,从上到下金属性减弱,所以氢化物的稳定性减弱,H2O最稳定;综上所述,本题答案是:H2O。
(4)c为O,f为Na, 形成过氧化钠,钠离子和过氧根离子间为离子键,两个氧原子之间为共价键,过氧化钠电子式为:![]() ;综上所述,本题答案是:
;综上所述,本题答案是:![]() 。
。
(5)d为F、f为 Na、g为Mg,核外电子排布相同的离子,核电荷数越大,离子半径越小;因此三种离子F-、Na+、Mg2+中,离子半径最大的为F-;综上所述,本题答案是:F-。
(6)f为 Na,其最高价氧化物的水化物为氢氧化钠,h 为Al,其最高价氧化物的水化物为氢氧化铝,二者反应生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;综上所述,本题答案是:Al(OH)3+OH-=AlO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.ClO2是氧化产物
B.KClO3在反应中得到电子
C.H2C2O4在反应中被还原
D.1 mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
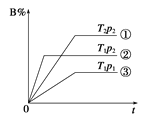
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )

A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为2 L的密闭容器中发生反应2X(g)+Y(g)![]() 2W(g) ΔH<0,当充入2 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是( )
2W(g) ΔH<0,当充入2 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是( )
①升高温度,W的体积分数减小,ΔH增大 ②以Y的浓度变化表示的反应速率为0.01 mol·L-1·s-1 ③在其他条件不变的情况下,增加1 mol X,则X和Y的转化率均提高 ④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动 ⑤再向容器中通入2 mol X和1 mol Y,达到平衡时,X、Y的转化率均增大
A. ⑤ B. ①⑤ C. ②③④ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为放热反应
C.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
D.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
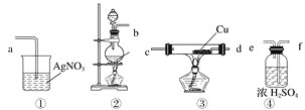
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图。已知锌的熔点420 ℃、沸点906 ℃。则下列说法不正确的是

A. 升炼倭铅过程包含分解反应和氧化还原反应
B. 冶炼时锌变为蒸气在兜室冷凝为固体
C. “泥封”的目的是为了防止得到的锌被氧化
D. “锌火”是锌蒸气和一氧化碳在空气的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的主要因素是

①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④ B. ③④ C. ①③ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com