
 P(g)+Q(g) △H>0,请回答下列问题。
P(g)+Q(g) △H>0,请回答下列问题。  桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:
 已知可逆反应:FeO(s)+CO(g)
已知可逆反应:FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度T与n(CO2)/n(CO)的比值关系如右下表所示.下列有关说法正确的是( )
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度T与n(CO2)/n(CO)的比值关系如右下表所示.下列有关说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?湖南二模)(1)已知可逆反应:M(g)+N(g)
(2011?湖南二模)(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:湖南省模拟题 题型:填空题
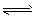 P(g)+Q(g) △H>0,请回答下列问题:
P(g)+Q(g) △H>0,请回答下列问题: 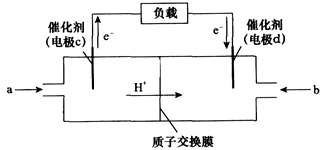
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com