
【题目】工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
【答案】放出92该反应是可逆反应,1 mol N2和3 mol H2不能完全反应,因此放出能量总是小于92 kJ0.25acf
【解析】
(1)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则反应的N2+3H2![]() 2NH3的ΔH=(946+436×3-391×6)kJ/mol=-92kJ/mol,所以若1mol N2完全反应生成NH3可放出热量92kJ。
2NH3的ΔH=(946+436×3-391×6)kJ/mol=-92kJ/mol,所以若1mol N2完全反应生成NH3可放出热量92kJ。
(2)由于该反应是可逆反应,1 mol N2和3 mol H2不能完全反应生成2mol氨气,因此放出能量总是小于92 kJ。
(3)在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则消耗氮气5mol,浓度是2.5mol/L,用N2表示的化学反应速率是2.5mol/L÷10min=0.25 mol·L -1·min-1。
(4)a.达到化学平衡时,正反应速率和逆反应速率一定相等,a正确;
b.达到化学平衡时,正反应速率和逆反应速率一定相等,且均不为0,b错误;
c.达到化学平衡时,即达到反应最大限度,N2的转化率达到最大值,c正确;
d.达到化学平衡时,N2和H2的浓度不再改变,但不一定相等,d错误;
e.达到化学平衡时,N2、H2和NH3的体积分数不变,但不一定相等,e错误;
f.达到化学平衡时,反应达到最大限度,f正确。
答案选acf。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_________________。(填化学式)
(2)在合成塔中,若有4400g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,该反应的热化学方程式为_________________。
(3)一定条件下,往2 L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是_________________(填“反应I”、“反应II”、“反应III”)。同一种催化剂,温度越高,催化效果_________________(填“不变”、“增强”、“减弱”),分析其原因可能是_________________(填字母)。
A.温度升高,平衡逆向移动 B.温度升高,催化剂失活
C.温度升高,催化剂脱附率增加 D.温度升高,平衡常数减小
②b点v(正)________v(逆)(填“>”、“<”或“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________________。
④c点时该反应的平衡常数K=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
B. 充电时,当阳极质量增加23.9 g时,溶液中有0.2 mol电子通过
C. 放电时,正极区pH增大
D. 充电时,Pb电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果,下列图像描述正确的是
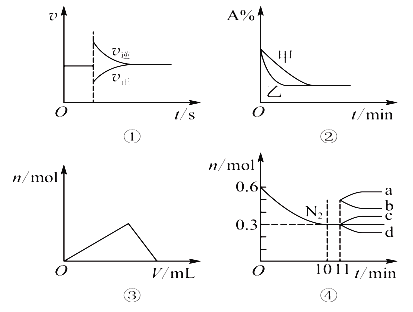
A. 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,且甲的压强大
3C(g)+D(g)的影响,且甲的压强大
C. 图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系
D. 图④表示在2 L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe3++SO32-+H2O![]() 2Fe2++SO42-+2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是
2Fe2++SO42-+2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是

A.G的指针指向B极
B.U中阳离子向A极移动
C.一段时间后,化学反应达到平衡状态,导线中无电流通过
D.一段时间后,B中溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成化合物的化学式最可能表示为( )
A.B3A2B.BA2
C.A3B2D.AB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 1 mo1CH3+(碳正离子)中含有电子数为10NA
B. 标准状况下,22.4L己烷中所含的碳原子数为6 NA
C. 28g乙烯和丙烯的混合气体中所含的氢原子数为4 NA
D. 1.8g的NH4+中含有的电子数为10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
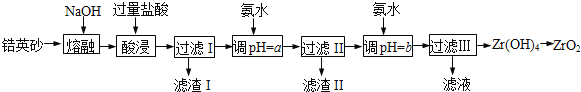
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为___________________________________________,滤渣I的化学式为___________________
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是____________________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为:________________________________________
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是:____________________________
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:___SiO2 + C + N2![]() Si3N4 + CO
Si3N4 + CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。__________
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30 mol氮气,反应生成了5 mol一氧化碳,则此时混合气体的平均摩尔质量是______________。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是__________(填序号)
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,电极反应式为2H2O+2e-===2OH-+H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com