
【题目】A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.
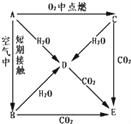
(1)这五种物质中,A: ___________、 C: ___________.
(2)将CO2通入E的饱和溶液中,该反应的离子方程式为______________________________.
(3)写出A→D、C→D、C→E反应的化学方程式
A→D:___________________________.
C→D:___________________________.
C→E:___________________________.
【答案】 Na Na2O2 CO2+H2O+2Na++CO32﹣=2NaHCO3↓ 2Na+H2O=2NaOH+H2↑ 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
【解析】A在氧气中燃烧生成C,A在空气中短期接触生成B,A与水反应生成D,且A、B、C都能和水反应生成D,B、C都是氧化物,都和水反应生成D,D只能为碱A、B、C、D、E五种物质的焰色反应均为黄色说明含有钠元素,故A为Na,C为Na2O2,D为NaOH,E是Na2CO3,Na在空气中短期接触生成B,B为Na2O,Na2O与CO2反应生成Na2CO3,与水反应生成NaOH。
(1)由以上分析可知A为Na,C为Na2O2,故答案为:Na;Na2O2;
(2)E是Na2CO3,将CO2通入E的饱和溶液中,生成碳酸氢钠沉淀,反应的离子方程式为CO2+H2O+2Na++CO32-=2NaHCO3↓,故答案为:CO2+H2O+2Na++CO32-=2NaHCO3↓;
(3)A→D的反应是钠和水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,C→D为过氧化钠和水的反应,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,C→E为过氧化钠和二氧化碳反应生成碳酸钠和氧气,方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na+H2O=2NaOH+H2↑;2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2。


科目:高中化学 来源: 题型:
【题目】某有机物由C、H、0三种元素组成,其相对分子质量为74,所含氧元素的质量分数约为 0.43,且该有机物能与NaOH溶液反应。则该有机物的结构(不包括立体异构)共有( )
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,非金属元素A的最外层电子数与其周期数相等,B的成对电子与未成对电子所占据的原子轨道数相等。单质B在单质C中充分燃烧生成BC2。 D+与C2-具有相同的电子数。A在E中燃烧,产物溶于水会得到一种强酸。
(1)B在元素周期表中的位置是________,写出一种工业制备单质E的化学方程式:_____。
(2)B、C、D组成的一种盐中,B的质量分数为17. 91%,D的质量分数为34. 3 3%。该盐的化学式为________,其阴离子中B原子的杂化方式为__________。
(3)由这些元素组成的某些物质的组成和结构信息如下表:
物质 | 组成和结构 |
a | A、D两元素组成的离子化合物 |
b | 由C、D两元素组成的含有非极性键的离子化合物 |
c | 化学组成为BCE2 |
a的电子式为_________;b的化学式为________;c的空间构型为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是物质的量概念及其相关计算的内容,完成相关填空:
(1)标准状况下,① 4 g氢气、②33.6 L甲烷、③6.02×1023个水分子中,含分子数最多的是(填序号,下同)_______,含原子数最多的是_________,质量最大的是___________,体积最小的是___________。
(2)在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加德罗常数可表示为___________。
(3)19 g某二价金属的氯化物ACl2中含有0.4 mol Cl-,A的相对原子质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学应用如图所示装置研究气体的性质.现有某气体,其主要成分是氯气,还含有少量空气和水蒸气,请回答:
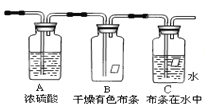
(1)实验室用二氧化锰和浓盐酸制取氯气____________(写化学方程式),该实验研究的主要目的是 。浓硫酸的作用是 。
(2)B、C中能观察到的实验现象是
B中 ;
C中 .
(3)氯水里面含有较多成分,氯水呈黄绿色,起作用的是 ,将紫色石蕊溶液滴入氯水中,氯水显红色,过一会儿,红色消失,起作用的成分是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。已知一种合成阿魏酸的反应可表为:
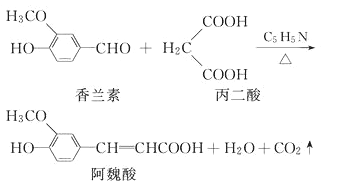
对以上反应说法正确的是
A. 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与Na2CO3、NaOH 、NaHCO3溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 与香兰素互为同分异构体分子中有4种不同化学环境的氢,能消2molNaOH溶液且能发生银镜反应的酚类化合物共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关活化分子的说法正确的是( )
A. 增大反应物浓度可以提高活化分子百分数
B. 增大体系的压强一定能提高活化分子百分数
C. 使用合适的催化剂可以增大活化分子的能量
D. 升高温度能提高活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)== CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s) △H= —489.0kJ/mol
则4Fe(s)+3O2(g)==2Fe2O3(s)的反应热ΔH为( )
A.-1641.0kJ/mol B.+3081kJ/mol
C.+663.5kJ/mol D.-2507.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,向如图所示的容器(密封的隔板可自由滑动)中加入4LN2和H2的混合气体, 在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度。平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5。
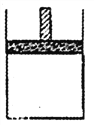
(1)反应前混合气体中V(N2):V(H2)= _______, 反应达到平衡后V(NH3)= _______L,该反应中N2转化率为______。
(2)向平衡后的容器中充入0. 2mol的NH3,一段对间后反应再次达到平衡,恢复到150℃时测得此过程中从外界吸收了 6.44kJ的热量;
①充入NH3时,混合气体的密度将_________,在达到平衡的过程中,混合气体的密度将_______(填“增大”、“减小”或“不变”);反应重新达平衡的混合气体对氢气的相对密度将_____5(填“ >”、“ <”或“=”)。
②下列哪些实验现象或数据能说明反应重新到达了平衡 _______;
A.容器不再与外界发生热交换
B.混合气体的平均相对分子质量保持不变
C.当K( N2):V( H2):F( NH3) = 1:3:2时
D.当容器的体积不再发生变化时
③写出该反应的热化学方程式: __________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com