
| A. | 96g | B. | 96g/mol | C. | 98g | D. | 98g/mol |
科目:高中化学 来源: 题型:选择题
| A. | 符合通式Cm(H2O)n的一定是糖 | |
| B. | 糖类组成一定符合通式Cm(H2O)n | |
| C. | 糖类是人类维持生命的六大类营养素之一 | |
| D. | 糖类是有甜味的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe是氧化剂 | B. | Fe2O3被还原 | ||
| C. | A1 发生了还原反应 | D. | Fe2O3失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内的压强不随时间而变化 | B. | 混合气体的密度不再随时间而变化 | ||
| C. | P和R的生成速率相等 | D. | 容器内P、Q、R、S共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
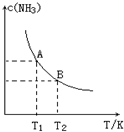 将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.
将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于正四面体的空间结构 | B. | 对环境无污染 | ||
| C. | 没有同分异构体 | D. | 是甲烷的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com