
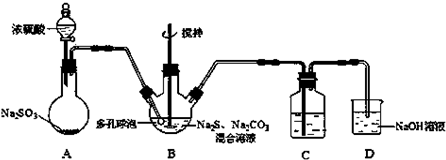
分析 装置A为二氧化硫的制取:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,B装置为Na2S2O3的生成装置:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,二氧化硫能和品红作用,二氧化硫能被高锰酸钾氧化,能与溴单质,上述溶液均褪色,所以装置C中盛放品红、溴水或KMnO4溶液,其作用是检验装置B中SO2的吸收效率,二氧化硫有毒,不能直接排放到空气中,装置D作用为尾气吸收装置,吸收未反应的二氧化硫.
(1)装置A为二氧化硫的制取,亚硫酸钠和浓硫酸发生复分解反应生成硫酸钠和水和二氧化硫;
(2)根据题目信息SO2、Na2S和Na2CO3反应生成Na2S2O3,结合质量守恒确定产物并配平,硫代硫酸钠晶体易溶于水,难溶于乙醇生成的硫代硫酸钠粗品可用乙醇洗涤;
(3)装置B的作用是检验装置A中SO2的吸收效率,说明B中物质能与二氧化硫反应,且有明显的现象,一般可为品红、溴水或KMnO4溶液;加快反应速率,可增大接触面积,增大浓度、升高温度等;
(4)已知室温时CaCO3饱和溶液的pH=9.5,若要检验氢氧化钠存在,需加入过量CaCl2溶液,把Na2CO3转化为CaCO3,再测量溶液的pH,若pH大于9.5,说明含有NaOH.
解答 解:(1)装置A为二氧化硫的制取,亚硫酸钠和浓硫酸发生复分解反应:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,生成二氧化硫,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式为:4SO2+2Na2S+Na2CO3=CO2↑+3Na2S2O3,离子反应为:4SO2+2S2-+CO32-=CO2↑+3S2O32-,硫代硫酸钠晶体易溶于水,难溶于乙醇,乙醇易挥发,生成的硫代硫酸钠粗品可用乙醇洗涤,
故答案为:4SO2+2S2-+CO32-=CO2↑+3S2O32-;乙醇;
(3)装置B的作用是检验装置A中SO2的吸收效率,说明B中物质能与二氧化硫反应,且有明显的现象,一般可为品红、溴水或KMnO4溶液等,如A中SO2吸收效率低,则B中进入较多的二氧化硫,导致B中溶液颜色很快褪色,加快反应速率,可增大气体与液体的接触面积,增大浓度,加快二氧化硫的流速、升高温度等,
故答案为:品红、溴水或KMnO4溶液;褪色;控制SO2的流速(或增大SO2的接触面积或适当升高温度);
(4)检验氢氧化钠存在,需加入过量CaCl2溶液,把Na2CO3转化为CaCO3,再测量溶液的pH,实验方案为:取少量样品于试管(烧杯)中,加水溶解,加入过量的CaCl2溶液,振荡(搅拌),静置,用pH计测定上层清液的pH,若pH>9.5,则含有NaOH,
故答案为:取少量样品于试管(烧杯)中,加水溶解,加入过量的CaCl2溶液,振荡(搅拌),静置,用pH计测定上层清液的pH,若pH>9.5,则含有NaOH.
点评 本题考查了硫代硫酸钠晶体制备实验方案的设计和制备过程分析应用,主要是实验基本操作的应用、二氧化硫的性质的探究,侧重于学生的分析能力、实验能力的考查,为高考常见题型和高频考点,注意把握物质的性质以及实验原理的探究,题目难度中等.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8 g CH4含有4NA个氢原子 | |
| B. | 2gD216O中含有的质子数为2NA个 | |
| C. | 1 mol Cu与足量FeCl3溶液反应,转移2NA个电子 | |
| D. | 通常状况下,2.24 L氮气含有0.1NA个N2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 (s)浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
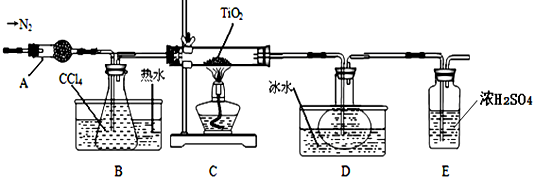
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,一定有化学键的断裂和形成 | |
| B. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 | |
| C. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| D. | 放热反应的反应速率,一定比吸热反应的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:
原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| B. | 50mL18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 78g Na2O2晶体中含有的离子数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com