

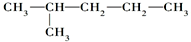 与
与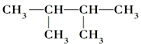
分析 根据结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;分子式相同,结构不同的化合物互称为同分异构体;质子数相同中子数不同的原子互称同位素;同种元素形成的不同单质互为同素异形体;同种物质指组成和结构都相同的物质;然后对照概念分析.
解答 解:(1)18O和16O中子数不同,是氧元素的不同原子,互为同位素;(2)盐酸是氯化氢的水溶液;
(3)O2和O3是氧元素组成的结构不同的单质,互为同素异形体;
(4) 组成和结构都相同,为同一物质;
组成和结构都相同,为同一物质;
(5)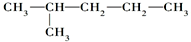 与
与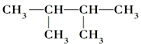 分子式相同,结构不同,为同分异构体;
分子式相同,结构不同,为同分异构体;
(6)C(CH3)4与(CH3)2CHCH2CH2CH3结构相似,都属于烃,分子组成相差1个CH2原子团,互为同系物;
故答案为:(6);(5);(1);(3);(4).
点评 本题主要考查了同系物、同分异构体、同位素、同素异形体、同一物质的区别,难度不大,注意把握概念的内涵与外延.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
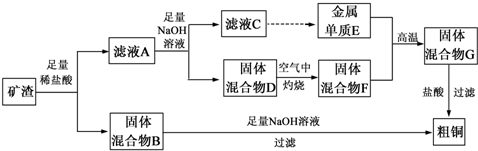
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
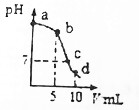 25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
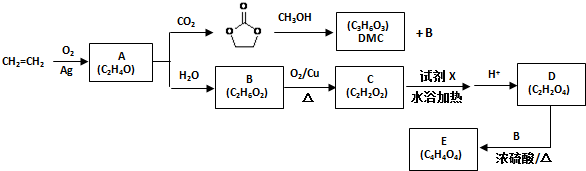
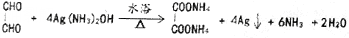 .
.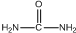 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式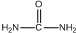 +2CH3OH$→_{△}^{催化剂}$
+2CH3OH$→_{△}^{催化剂}$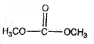 +2NH3↑.
+2NH3↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
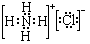 ;②B溶于水的过程中存在的可逆反应式为NH3+H2O
;②B溶于水的过程中存在的可逆反应式为NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阳极质量不变 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Cu2O固体可使溶液恢复到电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、Mg2+、NO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | HCO3-、NH4+、Ag+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com