
 £®
£® ·ÖĪö £Ø1£©ŅŅĻ©ŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬æÉÓėäå·¢Éś¼Ó³É·“Ӧɜ³ÉCH2Br-CH2Br£¬ČÜŅŗĶŹÉ«£»
£Ø2£©ŅŅĻ©æɱ»ĖįŠŌøßĆĢĖį¼ŲČÜŅŗŃõ»Æ£¬øßĆĢĖį¼Ų±»»¹Ō£»
£Ø3£©ŅŅĻ©ÓėĖ®·¢Éś¼Ó³É·“Ӧɜ³ÉŅŅ“¼£»
£Ø4£©n=$\frac{5.6L}{22.4L/mol}$=0.25mol£¬M=$\frac{10.5g}{0.25mol}$=42g/mol£¬n£ØCO2£©=$\frac{16.8L}{22.4L/mol}$=0.75mol£¬æÉÖŖŗ¬ÓŠ3øöCŌ×Ó£¬n£Ø$\frac{13.5g}{18g/mol}$£©=0.75mol£¬æÉÖŖÓŠ»śĪļŗ¬ÓŠ6øöHŌ×Ó£®
½ā“š ½ā£ŗ£Ø1£©ŅŅĻ©ŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬æÉÓėäå·¢Éś¼Ó³É·“Ӧɜ³ÉCH2Br-CH2Br£¬·½³ĢŹ½ĪŖ CH2=CH2+Br2”śCH2Br-CH2Br£¬ČÜŅŗĶŹÉ«£¬
¹Ź“š°øĪŖ£ŗČÜŅŗ»ĘÉ«ĶŹČ„£» CH2=CH2+Br2”śCH2Br-CH2Br£» ¼Ó³É·“Ó¦£»
£Ø2£©ŅŅĻ©æɱ»ĖįŠŌøßĆĢĖį¼ŲČÜŅŗŃõ»Æ£¬øßĆĢĖį¼Ų±»»¹Ō£¬æɹŪ²ģµ½øßĆĢĖį¼ŲČÜŅŗ×ĻÉ«ĶŹČ„£¬¹Ź“š°øĪŖ£ŗøßĆĢĖį¼ŲČÜŅŗ×ĻÉ«ĶŹČ„£»
£Ø3£©ŅŅĻ©ÓėĖ®·¢Éś¼Ó³É·“Ӧɜ³ÉŅŅ“¼£¬·½³ĢŹ½ĪŖCH2=CH2+H2O$\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$CH3CH2OH£¬¹Ź“š°øĪŖ£ŗCH2=CH2+H2O$\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$CH3CH2OH£»
£Ø4£©n=$\frac{5.6L}{22.4L/mol}$=0.25mol£¬M=$\frac{10.5g}{0.25mol}$=42g/mol£¬n£ØCO2£©=$\frac{16.8L}{22.4L/mol}$=0.75mol£¬æÉÖŖŗ¬ÓŠ3øöCŌ×Ó£¬n£Ø$\frac{13.5g}{18g/mol}$£©=0.75mol£¬æÉÖŖÓŠ»śĪļŗ¬ÓŠ6øöHŌ×Ó£¬ŌņÓ¦ĪŖ±ūĻ©£¬·¢Éś¼Ó¾Ū·“Ӧɜ³É¾Ū±ūĻ©£¬·½³ĢŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £®
£®
µćĘĄ ±¾Ģā×ŪŗĻæ¼²éŅŅĻ©µÄŠŌÖŹ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲѧɜµÄ·ÖĪö”¢¼ĘĖćÄÜĮ¦µÄ漲飬±¾Ģā×¢Ņā°ŃĪÕÓŠ»śĪļ¹ŁÄÜĶŵĊŌÖŹŅŌ¼°·Ö×ÓŹ½µÄĶʶĻĖ¼Ā·£¬“šĢāŹ±×¢Ņā°ŃĪÕ£¬ÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| »Æѧ¼ü | C-H | O-H | C=O | H-H |
| ĪüŹÕČČĮæ£ØkJ/mol£© | 414 | 464 | 803 | 436 |
| A£® | 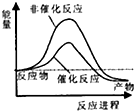 | B£® | 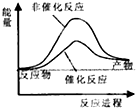 | C£® | 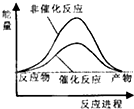 | D£® | 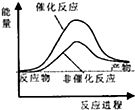 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĢžµÄ×é³É¾ł·ūŗĻĶØŹ½CnH2n+2 | |
| B£® | ĢžĄą¾ł²»ČÜÓŚĖ® | |
| C£® | ¼×ĶéŌŚĢžÖŠŗ¬Ģ¼Įæ×īµĶ | |
| D£® | ¼×ĶéÖ»ÄÜ·¢ÉśČ”“ś·“Ó¦¶ų²»ÄÜ·¢Éś¼Ó³É·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«±„ŗĶĀČĖ®µĪµ½Ą¶É«ŹÆČļŹŌÖ½ÉĻ£¬ŹŌÖ½ĻȱäŗģŗóĶŹÉ«£¬Ö¤Ć÷ĀČĖ®¾ßÓŠĘư׊Ō | |
| B£® | ĻņHClOČÜŅŗÖŠĶØČėSO2£¬Éś³ÉH2SO4£¬Ö¤Ć÷H2SO4µÄĖįŠŌ±ČHClOĒæ | |
| C£® | ½«ĀĮ²ŌŚ¾Ę¾«µĘ»šŃęÉĻ¼ÓČČ£¬ĀĮ²ČŪ»Æµ«²»µĪĀ䣬֤Ć÷Ńõ»ÆĀĮµÄČŪµćøßÓŚĀĮ | |
| D£® | ĻņNa2SiO3ČÜŅŗÖŠµĪ¼Ó·ÓĢŖ£¬ČÜŅŗ±äŗģ£¬Ö¤Ć÷Na2SiO3·¢ÉśĮĖ·“Ó¦¶ų³É¼īŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | K+””””Na+””””OH-””””SO42- | B£® | Mg2+””””SO42-””””NH4+””””Cl- | ||
| C£® | K+””””Na+””””HCO3-””””Cl- | D£® | K+”””” Na+”””” NO3-””””CO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 17g°±ĘųÖŠĖłŗ¬Ō×ÓŹżĪŖNA | |
| B£® | ±ź×¼×“æöĻĀ£¬1 LĖ®ÖŠĖłŗ¬·Ö×ÓŹżĪŖ$\frac{1}{22.4}$NA | |
| C£® | 0.3 mol/LµÄMgCl2ČÜŅŗÖŠŗ¬Mg2+ŹżÄæ0.3 NA | |
| D£® | ³£ĪĀ³£Ń¹ĻĀ£¬16 g O2ŗ¬ÓŠµÄŃõŌ×ÓŹżĪŖNA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬2.24 L±½ÖŠŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.1 NA | |
| B£® | ±ź×¼×“æöĻĀ£¬2.24 L Cl2Óė¹żĮæĻ”NaOHČÜŅŗ·“Ó¦£¬×ŖŅʵĵē×Ó×ÜŹżĪŖ0.1 NA | |
| C£® | 0.1 mol•L-1µÄĮņĖįĶČÜŅŗÖŠŗ¬ĶĄė×ÓŹżĪŖ0.1 NA | |
| D£® | 1mol FeCl3øśĖ®ĶźČ«·“Ó¦×Ŗ»ÆĪŖĒāŃõ»ÆĢś½ŗĢåŗó£¬ĘäÖŠ½ŗĢåĮ£×ӵďżÄæĪŖNA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪĀ¶ČÉżøߣ¬Ksp£ØAgCl£©²»±ä | |
| B£® | Ļņ±„ŗĶAgClĖ®ČÜŅŗÖŠ¼ÓČėNaClČÜŅŗ£¬Ksp£ØAgCl£©±ä“ó | |
| C£® | ³£ĪĀĻĀ£¬½«0.001 mol•L-1 AgNO3ČÜŅŗµĪČė0.001 mol•L-1 KClŗĶ 0.001 mol•L-1 K2CrO4ČÜŅŗĻČ²śÉśAg2CrO4³Įµķ | |
| D£® | ŌŚMg2+ĪŖ0.12 mol•L-1µÄČÜŅŗÖŠŅŖ²śÉśMg£ØOH£©2³Įµķ£¬Ó¦æŲÖĘČÜŅŗµÄpH£¾9 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com