
| A. | NaCl、NaBr、KI三种无色溶液 | |
| B. | HCl、CaCl2、NaNO3、Na2CO3四种溶液 | |
| C. | NaBr、HCl、KCl三种溶液 | |
| D. | 氯化钠、淀粉碘化钾、溴化钾、溴水四种溶液 |
分析 A.均为无色,相互之间不反应;
B.Na2CO3与盐酸反应生成气体,Na2CO3与CaCl2反应生成白色沉淀;
C.均为无色,相互之间不反应;
D.溴水为橙色,但溴水与NaCl、KBr均互反应.
解答 解:A.均为无色,相互之间不反应,则不用任何试剂,不能鉴别,故A错误;
B.Na2CO3与盐酸反应生成气体,Na2CO3与CaCl2反应生成白色沉淀,硝酸钠与其它三种物质均不反应,则不用任何试剂可鉴别,故B正确;
C.均为无色,相互之间不反应,则不用任何试剂,不能鉴别,故C错误;
D.溴水为橙色,溴与KI反应生成碘,可检验淀粉碘化钾,但溴水与NaCl、KBr均互反应,则则不用任何试剂,不能鉴别NaCl、KBr,故D错误;
故选B.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:选择题

| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 由图可知该温度下醋酸的电离常数为1×10-4.75 | |
| C. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| D. | 向1L W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):2c(H+)+c(CH3COOH)═c(CH3COO-)+2c(OH-)+2 c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
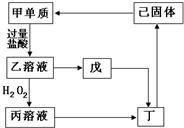 已知甲、乙、丙、丁、戊、己六种物质中含同一种元素,它们之间的转化关系如图所示.其中,丁是一种红褐色沉淀,戊是一种白色沉淀.请回答下列问题:
已知甲、乙、丙、丁、戊、己六种物质中含同一种元素,它们之间的转化关系如图所示.其中,丁是一种红褐色沉淀,戊是一种白色沉淀.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Y、Z三种物质,它们之间存在如图转化关系:
有X、Y、Z三种物质,它们之间存在如图转化关系: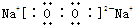 ;Y、Z两种物质相比,相同的化学键类型为离子键,当由X制取Z的上述两种途径生成Z的量相等时,转移电子数目比为1:2.
;Y、Z两种物质相比,相同的化学键类型为离子键,当由X制取Z的上述两种途径生成Z的量相等时,转移电子数目比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3-,Cl-,K+ | B. | ClO-,Cl-,H+ | ||
| C. | NaClO,NaClO3,NaNO3 | D. | NaClO,Na2SO4,NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(4)(5)(6) | B. | (1)(3)(4)(5)(6) | C. | (1)(2)(3)(5)(6) | D. | 只有(1)(3)(5) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com