
| ||
| 2 |
| 1 |
| 20 |
| 1 |
| 4 |
| 192g×0.02mol |
| 2mol |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
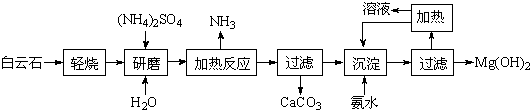
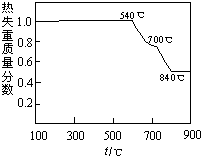
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象或预期试验先行 | 现象解释(用离子方程式表示) | ||
| 猜想② | (1) | 溶液PH=8 | --- | |
| 向PH=2的硫酸中滴加Na2S2O3溶液 | (2) | S2O
| ||
| 猜想③ | 向新制氯水(PH<2)中滴加少许Na2S2O3溶液 | 氯水颜色变浅 | (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
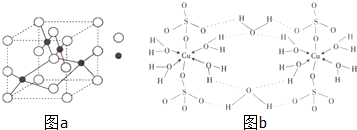
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔质量:g?mol-1 |
| B、密度:g?mL-1 |
| C、气体摩尔体积:L |
| D、阿伏加德罗常数:mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
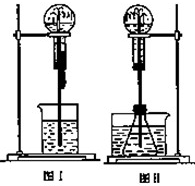 喷泉是一种常见的实验现象(如图),其产生原因是存在压强差.
喷泉是一种常见的实验现象(如图),其产生原因是存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第Ⅳ族氢化物沸点:CH4<SiH4,则第Ⅴ族氢化物沸点:NH3<PH3 |
| B、第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
| C、可电解熔融氯化镁制取金属镁,则也能用电解熔融氯化铝制取金属铝 |
| D、晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com