
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)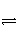
 Si(s)+4HCl(g)
Si(s)+4HCl(g)
ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
下列关于各溶液的描述中正确的是
A. pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4的溶液中,c(NH4+)大小:①=②>③
B. 常温下,在10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL
C. 向1.00L 0.3mol·L-1的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中:3c(Na+)=2[c(HCO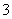 )+c(CO
)+c(CO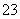 )+c(H2CO3)]
)+c(H2CO3)]
D. 浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
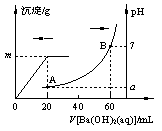
25℃时,下列各溶液中有关微粒物质的量浓度关系正确的是
A.0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S)
B.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合:
c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)
C.0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合:
c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+)
D.0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:
c(Na+)>c(NH4+)>c(SO42-)>c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下向1L pH=2的醋酸溶液中加入2L pH=2的盐酸,则混合溶液的pH为(假设混合后溶液体积不变,室温下醋酸的电离平衡常数为1.8×10-5)( )
A.2.3 B.1.7 C.2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y===2Z,其平衡常数为1 600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应CO2(g)+H2(g)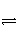
 CO(g)+H2O(g),其
CO(g)+H2O(g),其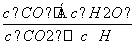 =K,K被称为化学平衡常数,其中K和温度的关系如下表:
=K,K被称为化学平衡常数,其中K和温度的关系如下表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是( )
A.此反应为放热反应
B.此反应只有达到平衡时,密闭容器中的压强才不会变化
C.此反应达到1 000 ℃时的反应速率比700 ℃时大
D.该反应的化学平衡常数越大,反应物的转化率越低
查看答案和解析>>
科目:高中化学 来源: 题型:
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g)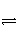
 N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
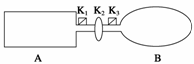
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深。
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1.2 mol。
(1)烃A的分子式为________。
(2)若取一定量的A完全燃烧后,生成B、C各3 mol,则有________ g烃A参加了反应,燃烧时消耗标准状况下的O2________L。
(3)若烃A不能使溴水退色,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,则A的结构简式为________。
(4)若烃A能使溴水退色,在催化剂作用下与H2加成,其加成产物分子中含有4个甲基,则A可能的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
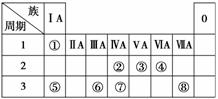
(1)④、⑤、⑥的原子半径由大到小的顺序是__________________________________________________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
_________________________________________________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________________________________________________________
_________________________________________________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com