
| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.7 |
| Zn2+ | 6.4 | 8.0 |
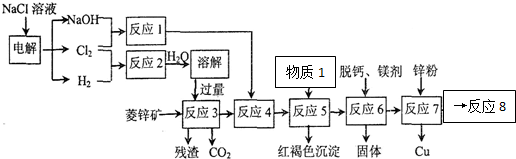
分析 依据流程分析,反应1是氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠,反应2是氢气和氯气反应生成氯化氢溶于水得到盐酸,用来溶解菱锌矿,加入次氯酸钠溶液氧化亚铁离子,调节溶液PH加入氧化锌反应生成氢氧化铁沉淀,通过脱钙脱镁得到溶液中含氢离子、铜离子,加入锌反应生成氢气和铜过滤得到氯化锌溶液,电极氯化锌得到氢气和氯气,当浓度达到一定程度可以在阴极析出锌,以此解答该题.
解答 解:依据流程分析,反应1是氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠,反应2是氢气和氯气反应生成氯化氢溶于水得到盐酸,用来溶解菱锌矿,加入次氯酸钠溶液氧化亚铁离子,调节溶液PH加入氧化锌反应生成氢氧化铁沉淀,通过脱钙脱镁得到溶液中含氢离子、铜离子,加入锌反应生成氢气和铜过滤得到氯化锌溶液,电极氯化锌得到氢气和氯气,当浓度达到一定程度可以在阴极析出锌,
(1)电解饱和食盐水,阴极发生还原反应生成氢气,故答案为:阴;
(2)依据影响化学反应速率的因素分析判断,增大接触面积会增大反应速率,以提高浸取率,
故答案为:增大反应物的接触面积,加快反应速率,提高浸取率;
(3)反应4将Fe2+氧化为Fe3+,以便除去铁杂质,故答案为:将Fe2+ 氧化为Fe3+;
(4)为避免引入新杂质,加入氧化锌调节pH,为完全除去铁离子并防止生成氢氧化锌沉淀,调节pH为3.2-6.4,
故答案为:C;3.2-6.4;将Fe3+完全转化为Fe(OH)3除去;
(5)为避免锌离子的水解,防止生成氢氧化锌沉淀,加热溶液时,应通入足量的HCl气体,故答案为:抑制Zn2+(ZnCl2)的水解.
点评 本题考查了物质制备流程的分析判断,为高频考点和常见题型,涉及元素化合物性质、化学工艺流程、基本操作与方案设计、盐类水解、常用化学用语等,难度中等,是对所学知识的综合利用.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 同主族元素自上而下,得电子能力增强 | |
| B. | 最外层电子数小于4的一定是金属元素 | |
| C. | 同周期元素中ⅠA族元素的原子半径最小 | |
| D. | 非金属:Cl>S>P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 足量的铜与含2molH2SO4的浓硫酸充分反应,可生成NA个SO2分子 | |
| C. | 工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5NA | |
| D. | 3mol铁与足量的水蒸气充分反应,转移电子8NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-、Na+、SO42-、NO3- | B. | Na+、Mg2+、S2-、SO${\;}_{{3}^{\;}}$2- | ||
| C. | Na+、K+、Cl-、OH- | D. | K+、Ca2+、H+、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
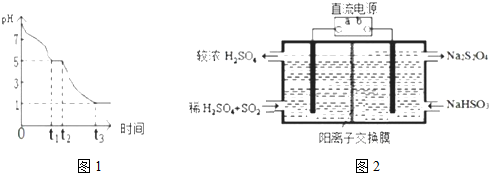
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com