
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
【答案】 120° sp2 正四面体 共价键 范德华力或分子间作用力 sp 3NA N2O NH3分子间存在氢键而CH4分子间只存在范德华力
【解析】①因为BF3分子的空间构型为平面三角形,所以F—B—F的键角是120°,B原子的杂化轨道类型为sp2, 在BF![]() 中中心原子B为sp3杂化,所以BF
中中心原子B为sp3杂化,所以BF![]() 的结构为正四面体构型;正确答案:120°;sp2 ; 正四面体。
的结构为正四面体构型;正确答案:120°;sp2 ; 正四面体。
②六方氮化硼晶体结构与石墨相似,所以B、N原子间以共价键相结合构成分子晶体,其层间的作用力为分子间作用力;正确答案:共价键;范德华力或分子间作用力。
(2)①乙炔分子为直线构型,分子中碳原子杂化方式为sp,1molC2H2分子中存在2个C-H σ键 ,C≡C键中有一个 σ键和2个π键,所以1molC2H2分子含有 3NAσ键;正确答案:sp;3NA。
②等电子体要符合原子总数和价电子数均相等;所以C与N分别形成的氧化物中符合等电子体的分子分别为:CO2、N2O;正确答案:N2O。
③由于氮原子半径较小,非金属性较强,与氢元素形成的氢化物中含有氢键,造成氨气的沸点反常,而甲烷分子中只存在分子间作用力,沸点较低;正确答案:NH3分子间存在氢键而CH4分子间只存在范德华力。


科目:高中化学 来源: 题型:
【题目】下列有机化合物中,都有多个官能团:
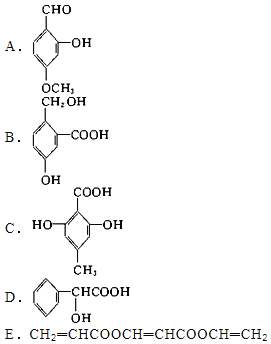
(1)可以看作醇类的是(填入编号,下同) ______。
(2)可以看作酚类的是 ______。
(3)可以看作羧酸类的是 ______。
(4)可以看作酯类的是 ______。
(5)可以看作醛类的是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空:
(1)3.1g由13C和18O组成的一氧化碳分子,其中含中子_______mol,电子_______个。
(2)现有①4.5gHD ②标准状况下44.8L氩气 ③4℃时9mL水 ④质子数为5NA的甲烷。其中所含原子数最多的是____________(填编号)
(3)下列物质: ①CO2 ②熔融的NaCl ③H2SO4 ④液态氯化氢 ⑤BaSO4 ⑥氯水 ⑦葡萄糖 ⑧ Cu (填编号)
属于电解质的是_________________________;
属于非电解质的是________________________;
能导电的是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得:
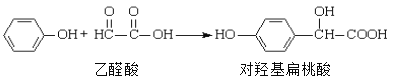
下列说法不正确的是
A. 上述反应的原子利用率可达到100%
B. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
C. 1mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
D. 可以用FeCl3溶液鉴别乙醛酸和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1=37.4kJ·mol-1
S(l)+2CO2(g) △H1=37.4kJ·mol-1
b.S(l)+2H2O(g)![]() 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为______。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)![]() CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
0min | 2 | 4 | 0 |
10min | 2 | ||
20min | 0.2 |
①前10min内的平均反应速率v(CO)=______;在20min时,温度T2下,该反应的化学平衡常数为_______。
②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_______(填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡状态的_____(填序号)。
CH3OH(g)反应达到平衡状态的_____(填序号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2
d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)![]() 2NO2的正反应速率v正=k1Cm(NO)Cn(O2
2NO2的正反应速率v正=k1Cm(NO)Cn(O2
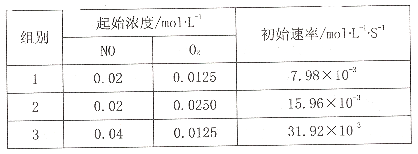
则k1=____,m=_____,n=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构.晶体中氧的化合价部分为0价,部分为﹣2价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元).则下列说法正确的是( )

A. 超氧化钾的化学式为KO2,每晶胞含有14个K+和13个O2﹣
B. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中,0价氧原子与﹣2价氧原子的数目比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可分为氧化还原反应和非氧化还原反应、离子反应和非离子反应。有下列反应:
①CO2+C![]() 2CO ②Cu2(OH)2CO3
2CO ②Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
③2NaOH+Cl2=NaCl+NaClO+H2O ④2CO+O2![]() 2CO2
2CO2
⑤3Fe+4H2O(g)![]() Fe3O4+4H2 ⑥CuO+H2
Fe3O4+4H2 ⑥CuO+H2![]() Cu+H2O
Cu+H2O
⑦2H2O![]() 2H2↑+O2↑ ⑧CO2+H2O=H2CO3
2H2↑+O2↑ ⑧CO2+H2O=H2CO3
(1)其中属于化合反应的有_____________(填序号,下同),属于置换反应的有_____________。
(2)在化学反应前后元素的化合价没有变化的是_______________________。
(3)上述反应中,既是分解反应,又是氧化还原反应的是_____________________。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是__________。
(5)根据你的理解,氧化还原反应的实质是(___________)
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_______。
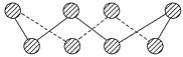
(2)H2Se的酸性比H2S________ (填“强”或“弱”)。气态SeO3分子的立体构型为________,SO32-离子的立体构型为________。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角________120°(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:
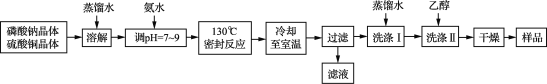
主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1) 实验室进行“过滤”操作使用的玻璃仪器主要有____________________。
(2) 流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是__________________。
(3) 准确称取上述流程所得的样品38.56 g [假定样品中只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量的硝酸中,再加入氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为27.20 g。计算所得样品中磷酸氧铜的质量分数_______。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com