
| A. | 向AlCl3溶液中加入过量氨水 | B. | 向Al2(SO4)3溶液中加入过量KOH溶液 | ||
| C. | 向澄清石灰水中通入过量CO2 | D. | 向NaAlO2溶液中加入过量稀盐酸 |
分析 A、反应中生成的氢氧化铝只溶于强酸强碱,不溶于弱酸弱碱,故反应生成氢氧化铝和氯化铵后,氢氧化铝不与过量的氨水反应,最终出现氢氧化铝白色沉淀;
B、反应中Al2(SO4)3溶液与KOH溶液反应生成硫酸钾和氢氧化铝,氢氧化铝又溶解在过量的氢氧化钾溶液中,过程中出现白色沉淀,最终无沉淀;
C、向澄清石灰水中通入过量CO2,生成碳酸氢钙;
D、向NaAlO2溶液中加入过量稀盐酸,生成氯化铝和氯化钠;
解答 解:A、AlCl3溶液中加入过量氨水,反应为AlCl3+3NH3•H2O=AI(OH)3↓+3NH4Cl,生成的白色沉淀不溶于过量的氨水,故A正确
B、Al2(SO4)3溶液中加入过量KOH溶液,反应为Al3++3OH-=AI(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,故B错误;
C、向澄清石灰水中通入过量CO2,生成碳酸氢钙,无沉淀产生,故C错误;
D、向NaAlO2溶液中加入过量稀盐酸,生成氯化铝和氯化钠,无沉淀,故D错误;
故选A.
点评 本题考查了元素化合物知识,明确离子反应发生的条件及氢氧化铝的两性是解题关键,注意A选项为易错选项,氢氧化铝不溶于弱碱.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:解答题
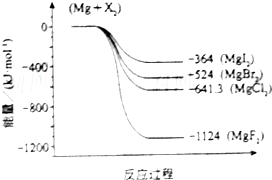 镁化合物和氯气均具有广泛用途,请回答下列问题:
镁化合物和氯气均具有广泛用途,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
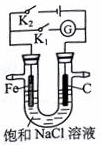
| A. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,立即有血红色出现 | |
| B. | K2闭合,电流方向由石墨棒经导线流向铁棒 | |
| C. | K2闭合,碳棒上发生还原反应,会生成黄绿色气体 | |
| D. | 将U型管支管封闭并闭合K1一段时间后,U型管中右侧液面会高于左侧液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- | |
| B. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 氨气通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| D. | 金属铝溶于盐酸中:Al+2H+═Al3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
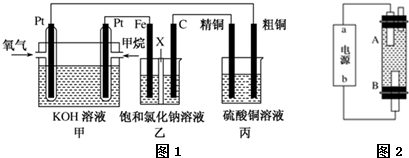
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,促进CO32-水解,pH减小 | |
| B. | 离子浓度:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| C. | 离子浓度:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +Br2
+Br2
 +HO-NO2
+HO-NO2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II |
| A | 油脂和汽油都是油 | 一定条件下都能发生皂化反应 |
| B | CuSO4可以用作游泳池消毒剂 | 铜盐能使蛋白质变性 |
| C | 蔗糖、淀粉、纤维素是还原性糖 | 它们一定条件下都能发生银镜反应 |
| D | 蛋白质结构中存在肽键 | 蛋白质能表现出两性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com