
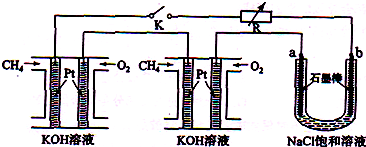
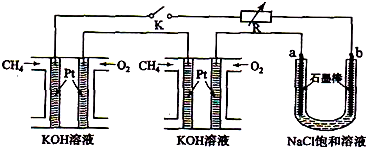
����Ч�ļ���ȼ�ϵ�ز��ò�Ϊ�缫���ϣ����缫�Ϸֱ�ͨ��CH4��O2�������ΪKOH��Һ��ij�о�С�齫����ȼ�ϵ����Ϊ��Դ�����Ȼ�þ��Һ���ʵ�飬���װ����ͼ��ʾ��
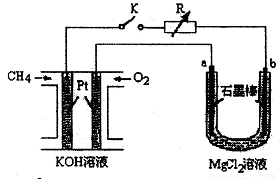
��ش��������⣺
��1������ȼ�ϵ�ظ����ĵ缫��ӦʽΪ�� ��
��2���պϿ���K��a��b�缫�Ͼ����������������a�缫�ϵ�������� ���飬b�缫�ϵõ��������� ������Ȼ�þ��Һ�����ӷ���ʽΪ ��
��3��������ͨ����Ϊ1.12 L����״�������ҷ�Ӧ��ȫ����������ͨ�����صĵ��ӵ����ʵ���Ϊ ���������������Ϊ L����״������
��4����֪���³�ѹ�£�0.25molCH4��ȫȼ������CO2��H2Oʱ���ų�222.5kJ��������д��CH4ȼ���ȵ��Ȼ�ѧ����ʽ ��
��֪����C��ʯī��+O2��g��=CO2��g����H1=-393��5kJ/mol
��2H2��g��+O2��g��=2H2O��l����H2=-571��6kJ/mol
���㣺C��ʯī����H2��g����Ӧ����1molCH4��g���ġ�H= ��
��1��CH4+ 10OH�D�D8e- = CO32��+7H2O
��2��ʪ��ĵ��۵⻯����ֽ ���� Mg2++2Cl��+2H2O = Mg(OH)2+ H2��+Cl2��
��3��0.4mol 4.48L
��4��CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) ��H= -890kJ/mol -75.1kJ/mol
��������
�����������װ���������ԭ��أ��ұ��ǵ��أ�aΪ������bΪ������(1)�����ڼ���������ʧȥ���ӣ��缫��ӦʽΪCH4+ 10OH�D�D8e- = CO32��+7H2O����2��a��������������ʪ��ĵ��۵⻯����ֽ���飻b��H+�ŵ磬������������ⷽ��ʽΪMg2++2Cl��+2H2O = Mg(OH)2+ H2��+Cl2����
��3��n(e-)=1.12��22.4��8=0.4mol v(Cl2)=0.4��2��22.4=4.48L
��4��0.25molCH4��ȫȼ������CO2��H2Oʱ���ų�222.5kJ������
1molCH4��ȫȼ�շų�����Ϊ222.5��4=890kJ��ȼ�����Ȼ�ѧ����ʽΪ
CH4(g)+2O2(g)=CO2(g)+ 2H2O(l) ��H= -890kJ/mol
��H=��H1+��H2������ȼ����=-75.1kJ/mol
���㣺���黯ѧ��Ӧ�������仯�й����⡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| 1L |
| 22.4L/mol |
| 1L |
| 22.4L/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com