
| A. | $\frac{ω}{5}$ g•mol-1 | B. | 2ωg | C. | 2ω g•mol-1 | D. | 4ω g•mol-1 |
分析 根据物质的量与阿伏伽德罗常数的关系:n=$\frac{N}{{N}_{A}}$,计算出气体的物质的量,再根据摩尔质量表达式:M=$\frac{m}{n}$,计算出Ne气体的摩尔质量.
解答 解:3.01×1023个Ne气体分子的物质的量为:n=$\frac{N}{{N}_{A}}$=$\frac{3.01×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$mol=5mol,
Ne气体的摩尔质量为:M=$\frac{m}{n}$=$\frac{ωg}{5mol}$=$\frac{ω}{5}$g/mol,
故选:A.
点评 本题考查了摩尔质量的计算,题目难度不大,注意掌握摩尔质量的计算公式M=$\frac{m}{n}$,本题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
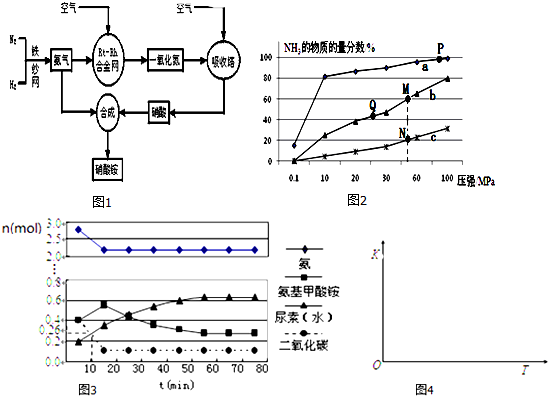
科目:高中化学 来源: 题型:实验题
 某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH将增大 | B. | Na+数和CO32-数的比值将变小 | ||
| C. | 溶液浓度不变,有晶体析出 | D. | 溶液浓度逐渐增大并有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
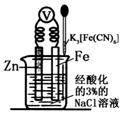
| A. | 该装置为电解池 | |
| B. | 本实验牺牲了金属Fe来保护金属Zn | |
| C. | 若加入K3[Fe(CN)6]溶液后,Fe电极附近不会产生特征蓝色的沉淀 | |
| D. | 远洋货轮上镶嵌的金属Zn长时间没有什么变化,不需要更换 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com