
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,32g O2含有的氧原子数为2NA | |
| C. | 通常状况下,NA个CO2分子占有的体积为22.4L | |
| D. | 1L 0.1mol/L NaCl溶液中所含的Na+为NA |
分析 A.根据标准状况下H2O为液态来分析;
B.质量换算物质的量结合氧气分子式计算氧原子数;
C.通常状况下,Vm≠22.4L/mol;
D.氯化钠是盐完全电离生成钠离子和氯离子.
解答 解:A.标准状况下H2O为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故A错误;
B.32g O2物质的量为1mol,含有的氧原子数为2NA,故B正确;
C.通常状况下,Vm≠22.4L/mol,无法计算二氧化碳的体积,故C错误;
D.1L 0.1mol/L NaCl溶液中所含的Na+为0.1NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量计算微粒数,气体摩尔体积的条件应用,溶液中离子物质的量的计算,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):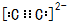 ,基态R原子的价电子排布式为3d64s2.
,基态R原子的价电子排布式为3d64s2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的融化热为6.0kJ.mol-1,冰中氢键键能为20kJ.mol-1.假设每摩尔冰中有2 mol 氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量CH3COONa固体,则电离平衡CH3COOH?CH3COO-+H+向左移动,a减小,Ka变小 | |
| C. | 实验测得环己烷(1).环己烯(1)和苯(1)的标准燃烧热分别为-3916kJ.mol-1、-3747kJ.mol-1和-3265kJ.mol-1,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═92Fe(s)+3CO(g)△H=489.0kJ.mol-1 CO(g)+$\frac{1}{2}$O2(g)═9CO2(g)△H=-283.0kJ.mol-1 C(石墨)+O2(g)═9CO2(g)△H=-393.5kJ.mol-1 则4Fe(s)+3O2(g)=94Fe2O3(s)△H=-1641.0kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ/mol | |
| C. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则可知C的燃烧热为11.5KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 L Cl2与5 L HCl | |
| B. | 36 g H2O与44.8 L CO2 | |
| C. | 25℃,1.01×105 Pa时,等体积的空气与H2 | |
| D. | 0.2 mol O2与标准状况下2.24 L水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加LaNi5H6(s)的量 | B. | 降低温度 | ||
| C. | 减小压强 | D. | 使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应不需要加热就能发生 | |
| B. | 升高温度或加入催化剂,均可以改变化学反应的反应热 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| D. | 一定条件下某吸热反应能自发进行,说明该反应是熵增大的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
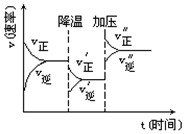 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 降温后逆反应速率增大 | B. | 逆反应是放热反应 | ||
| C. | A、B、C、D均为气体 | D. | 若A、B是气体,则D是液体或固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com