
”¾ĢāÄæ”æÄĘĄė×Óµē³ŲÕż³ÉĪŖ»ÆѧµēŌ“µÄŠĀ³č”£
(1)ÓŠŅ»ÖÖŠĀŠĶµÄøßÄܵē³Ų”ŖÄĘĮņµē³Ų(ČŪČŚµÄÄĘ”¢ĮņĪŖĮ½¼«£¬ŅŌNa£«µ¼µēµÄ¦ĀAl2O3ĢÕ“É×÷¹ĢĢåµē½āÖŹ)£¬·“Ó¦Ź½ĪŖ2Na£«xS ![]() Na2Sx”£
Na2Sxӣ
¢Ł³äµēŹ±£¬ÄĘ¼«ÓėĶāµēŌ“________(Ģī”°Õż”±»ņ”°øŗ”±)¼«ĻąĮ¬”£ĘäŃō¼«·“Ó¦Ź½£ŗ_____________”£
¢ŚÓĆøƵē³Ų×÷µēŌ“µē½ā(ČēĶ¼)NaClČÜŅŗ(×ćĮæ)£¬Š“³öµē½āNaClČÜŅŗµÄĄė×Ó·½³ĢŹ½£ŗ________________________________”£

¢ŪČōÓĆøĆÄĘĮņµē³Ų×÷µēŌ“ŌŚŅ»ĢśĘ¬ÉĻ¶ĘĶ£¬“ĖĢśĘ¬Óė__________(Ģī”°ÄĘ”±»ņ”°Įņ”±)¼«ĻąĮ¬”£
£Ø2£©”°Na£CO2”±µē³Ųæɽ«CO2±ä·ĻĪŖ±¦”£ĪŅ¹śæĘŃŠČĖŌ±ŃŠÖĘ³öµÄæɳäµē”° Na£CO2”±µē³Ų£¬ŅŌÄĘ²ŗĶ¶ą±ŚĢ¼ÄÉĆ×¹Ü(MWCNT)ĪŖµē¼«²ÄĮĻ£¬×Ü·“Ó¦ĪŖ4Na£«3CO2 ![]() 2Na2CO3£«C”£·ÅµēŹ±øƵē³Ų”°ĪüČė”±CO2£¬Ę乤×÷ŌĄķČēĶ¼ĖłŹ¾£ŗ
2Na2CO3£«C”£·ÅµēŹ±øƵē³Ų”°ĪüČė”±CO2£¬Ę乤×÷ŌĄķČēĶ¼ĖłŹ¾£ŗ

¢Ł·ÅµēŹ±£¬Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ_____________________________”£
¢ŚČōÉś³ÉµÄNa2CO3ŗĶCČ«²æ³Į»żŌŚµē¼«±ķĆę£¬µ±×ŖŅĘ0.2 mol e£Ź±£¬Į½¼«µÄÖŹĮæ²īĪŖ________ g”£
”¾“š°ø”æ øŗ Na2Sx£2e£===xS£«2Na£«(»ņS![]() £2e£===xS) 2Cl££«2H2O
£2e£===xS) 2Cl££«2H2O![]() 2OH££«H2”ü£«Cl2”ü ÄĘ 3CO2£«4Na£«£«4e£===2Na2CO3£«C 15.8
2OH££«H2”ü£«Cl2”ü ÄĘ 3CO2£«4Na£«£«4e£===2Na2CO3£«C 15.8
”¾½āĪö”æ(1)¢Ł·ÅµēŹ±£¬ÄĘĪŖŌµē³Ųøŗ¼«£»³äµēŹ±£¬ÄĘĪŖµē½ā³ŲµÄŅõ¼«£¬ÓėµēŌ“µÄøŗ¼«ĻąĮ¬£»øł¾Ż·“Ó¦¹ęĀÉŠ“Ńō¼«·“Ó¦Ź½”£
¢Śµē½ā±„ŗĶŹ³ŃĪĖ®Éś³ÉĒāŃõ»ÆÄĘ”¢ĒāĘųŗĶĀČĘų”£
¢ŪŌŚŅ»ĢśĘ¬ÉĻ¶ĘĶ,Ķ×÷Ńō¼«,Ģś×÷Ņõ¼«Ó¦Óėøŗ¼«ĻąĮ¬,ĖłŅŌČōÓĆøĆÄĘĮņµē³Ų×÷µēŌ“ŌŚŅ»ĢśĘ¬ÉĻ¶ĘĶ,“ĖĢśĘ¬Óėøŗ¼«ÄĘĻąĮ¬”£
£Ø2£©¢Ł·ÅµēŹ±£¬Õż¼«·¢Éś»¹Ō·“Ó¦£¬½įŗĻ×Ü·“Ó¦½ųŠŠŹéŠ“øƵē¼«·“Ó¦Ź½”£
¢ŚŅĄ¾Żµē×Ó×ŖŅĘŹŲŗć¹ęĀÉ£ŗøł¾ŻÕż¼«¼«·“Ó¦£¬½įŗĻµē×Ó×ŖŅĘĒéæö£¬¼ĘĖć³öÕż¼«ÖŹĮæµÄŌö¼ÓĮ棻øł¾Żøŗ¼«¼«·“Ó¦£¬½įŗĻµē×Ó×ŖŅĘĒéæö£¬¼ĘĖć³öøŗ¼«ÖŹĮæµÄŌö¼ÓĮ棻×īŗó¼ĘĖćĮ½¼«µÄÖŹĮæ²ī”£
(1)¢Łøł¾Żµē³Ų·“Ó¦Ź½ÖŖ,³äµēŹ±,ÄĘĄė×ӵƵē×Ó·¢Éś»¹Ō·“Ó¦,ĖłŅŌÄĘ×÷Ņõ¼«,Ó¦øĆĮ¬½ÓµēŌ“øŗ¼«£»Ńō¼«ÉĻŹ§µē×Ó·¢ÉśŃõ»Æ·“Ó¦,µē¼«·“Ó¦Ź½ĪŖNa2Sx£2e£===xS£«2Na£«(»ņS![]() £2e£===xS)£»ÕżČ·“š°ø:øŗ£»Na2Sx£2e£===xS£«2Na£«(»ņS
£2e£===xS)£»ÕżČ·“š°ø:øŗ£»Na2Sx£2e£===xS£«2Na£«(»ņS![]() £2e£===xS)”£
£2e£===xS)”£
¢Śµē½āNaClČÜŅŗ£¬Éś³ÉĒāŃõ»ÆÄĘ”¢ĒāĘųŗĶĀČĘų£¬Ąė×Ó·½³ĢŹ½£ŗ2Cl££«2H2O![]() 2OH££«H2”ü£«Cl2”ü£»ÕżČ·“š°ø£ŗ2Cl££«2H2O
2OH££«H2”ü£«Cl2”ü£»ÕżČ·“š°ø£ŗ2Cl££«2H2O![]() 2OH££«H2”ü£«Cl2”ü”£
2OH££«H2”ü£«Cl2”ü”£
¢ŪŌŚŅ»ĢśĘ¬ÉĻ¶ĘĶ,Ķ×÷Ńō¼«,Ģś×÷Ņõ¼«Ó¦Óėøŗ¼«ĻąĮ¬,ĖłŅŌČōÓĆøĆÄĘĮņµē³Ų×÷µēŌ“ŌŚŅ»ĢśĘ¬ÉĻ¶ĘĶ£¬“ĖĢśĘ¬Óėøŗ¼«ÄĘĻąĮ¬£»ÕżČ·“š°ø:ÄĘ”£
£Ø2£©¢ŁÕż¼«¶žŃõ»ÆĢ¼µĆµē×Ó·¢Éś»¹Ō·“Ó¦£¬¼«·“Ó¦ĪŖ£ŗ3CO2£«4Na£«£«4e£===2Na2CO3£«C£»ÕżČ·“š°ø£ŗ3CO2£«4Na£«£«4e£===2Na2CO3£«C”£
¢ŚÕż¼«·¢Éś¼«·“Ó¦ĪŖ3CO2£«4Na£«£«4e£===2Na2CO3£«C£¬øł¾Ż·“Ó¦¹ŲĻµæÉÖŖ£¬µ±×ŖŅĘ0.2 mol e£Ź±£¬øĆ¼«ÖŹĮæµÄĪŖm(Na2CO3)+m(C)=106”Į0.1+12”Į0.05=11.2 g£»øŗ¼«·¢Éś·“Ó¦ĪŖ4Na-4e£=4Na£«£¬øł¾Ż·“Ó¦¹ŲĻµæÉÖŖ£¬m(Na)=23”Į0.2=4.6 g£»Į½¼«µÄÖŹĮæ²īĪŖ11.2g+4.6g=15.8g£»ÕżČ·“š°ø£ŗ15.8”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķĪŖÖÜĘŚ±ķĒ°20ŗÅŌŖĖŲ֊ijŠ©ŌŖĖŲµÄÓŠ¹ŲŹż¾Ż£ŗ
ŌŖĖŲŠŌÖŹ | ¢Ł | ¢Ś | ¢Ū | ¢Ü | ¢Ż | ¢Ž | ¢ß | ¢ą | ¢į | ¢ā |
Ō×Ó°ė¾¶£Ø10-10m£© | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 | 0.64 |
×īøß¼ŪĢ¬ | +1 | +1 | ”Ŗ”Ŗ | +1 | +4 | +5 | +7 | +1 | +5 | ”Ŗ”Ŗ |
×īµĶ¼ŪĢ¬ | ”Ŗ”Ŗ | ”Ŗ”Ŗ | £2 | -1 | -4 | £3 | £1 | ”Ŗ”Ŗ | £3 | £1 |
ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ(ÓƶŌÓ¦µÄŌŖĖŲ·ūŗÅ»ņĪļÖŹµÄ»ÆѧŹ½±ķŹ¾)
£Ø1£©Š“³ö¢ąµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼£ŗ________£»
£Ø2£©ÉĻŹö¢Ż”¢¢Ž”¢¢ßŗÅŌŖĖŲ֊ij2ÖÖŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļÖŠ£¬ĆæŅ»øöŌ×Ó¶¼Āś×ć×īĶā²ćĪŖ8µē×ÓĪČ¶Ø½į¹¹µÄĪļÖŹæÉÄÜŹĒ______”¢____£»
£Ø3£©Ä³ŌŖĖŲRµÄŌ×Ó°ė¾¶ĪŖ1.04”Į10-10m£¬øĆŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ___________”£
£Ø4£©ŅŌÉĻ10ÖÖŌŖĖŲµÄŌ×ÓÖŠ£¬»¹ŌŠŌ×īĒæµÄŹĒ__________£ØŌŖĖŲ·ūŗÅ£©”£
£Ø5£©¢Ū”¢¢ß”¢¢Ł”¢¢āĖÄÖÖŌŖĖŲŠĪ³ÉµÄĄė×Ó£¬Ęä°ė¾¶ÓÉŠ”µ½“óµÄĖ³ŠņĪŖ___________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠČÜŅŗÖŠÓŠ¹ŲĪļÖŹµÄĮæÅØ¶Č¹ŲĻµÕżČ·µÄŹĒ
A. Na2S ČÜŅŗÖŠ c£ØOH©£©=c£ØH+£©+c£ØHS©£©+2c£ØH2S£©
B. Na2CO3ČÜŅŗÖŠ£ŗc£ØNa+£©=2c£ØCO32©£©+2c£ØHCO3©£©
C. ŹŅĪĀĻĀ£¬pH=1µÄCH3COOHČÜŅŗŗĶpH=13µÄNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬ČÜŅŗÖŠĄė×ÓÅØ¶ČµÄ“óŠ”Ė³Šņ£ŗc£ØNa+£©£¾c£ØCH3COO©£©£¾c£ØOH©£©£¾c£ØH+£©
D. pH=4µÄ0.1molL©1NaHC2O4ČÜŅŗÖŠc£ØH C2O4©£©£¾c£ØH+£©£¾c£ØH2C2O4£©£¾c£ØC2O42©£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹŹōÓŚ·Ēµē½āÖŹµÄŹĒ£Ø £©
A.¶žŃõ»ÆĢ¼B.ĮņĖįļ§¹ĢĢåC.Ė®D.ĒāŃõ»Æ¼ŲČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃĒĻõõ£ĀČ£ØClNO£©ŹĒÓŠ»śŗĻ³ÉÖŠµÄÖŲŅŖŹŌ¼Į”£æÉĶعż·“Ó¦»ńµĆ£ŗ2NO(g)+Cl2(g) ![]() 2ClNO(g)
2ClNO(g)
£Ø1£©ĒāŃõ»ÆĪļÓėŠüø”ŌŚ“óĘųÖŠµÄŗ£ŃĪĮ£×ÓĻą»„×÷ÓĆŹ±»įÉś³ÉŃĒĻõõ£ĀČ£¬Éę¼°ČēĻĀ·“Ó¦£ŗ
¢Ł2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
¢Ś4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
¢Ū2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
ŌņK3=______________£ØÓĆK1ŗĶK2±ķŹ¾£©”£
£Ø2£©°“Ķ¶ĮĻ±Č[n(NO):n(Cl2)=2:1]°ŃNOŗĶCl2¼ÓČėµ½Ņ»ŗćŃ¹µÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬Ę½ŗāŹ±NOµÄ×Ŗ»ÆĀŹÓėĪĀ¶ČT”¢Ń¹ĒæP£Ø×ÜŃ¹£©µÄ¹ŲĻµČēĶ¼AĖłŹ¾£ŗ
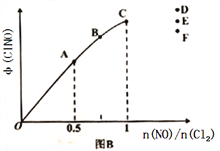
¢ŁøĆ·“Ó¦µÄ”÷H______0£ØĢī”°>”±”°<”±»ņ”°=”±£©£»
¢ŚŌŚPŃ¹ĒæĢõ¼žĻĀ£¬MµćŹ±ČŻĘ÷ÄŚNOµÄĢå»ż·ÖŹżĪŖ_________£»
¢ŪČō·“Ó¦Ņ»Ö±±£³ÖŌŚPŃ¹ĒæĢõ¼žĻĀ½ųŠŠ£¬ŌņMµćµÄ·ÖŃ¹Ę½ŗā³£ŹżKp=__________£ØÓĆŗ¬PµÄ±ķ“ļŹ½±ķŹ¾£¬ÓĆĘ½ŗā·ÖŃ¹“śĢęĘ½ŗāÅØ¶Č¼ĘĖć£¬·ÖŃ¹=×ÜŃ¹”ĮĢå»ż·ÖŹż£©”£
£Ø3£©Ņ»¶ØĢõ¼žĻĀŌŚŗćĪĀŗćČŻµÄĆܱÕČŻĘ÷ÖŠ°“Ņ»¶Ø±ČĄż³äČėNO(g)ŗĶCl2(g)£¬Ę½ŗāŹ±ClNOµÄĢå»ż·ÖŹżµÄ±ä»ÆĶ¼ĻńČēĶ¼B£¬ŌņA”¢B”¢CȿדĢ¬ÖŠ£¬NOµÄ×Ŗ»ÆĀŹ×ī“óµÄŹĒ_________µć£»µ±n(NO)/n(Cl2)=1.5Ź±£¬“ļµ½Ę½ŗāדĢ¬ClNOµÄĢå»ż·ÖŹżæÉÄÜŹĒD”¢E”¢FČżµćÖŠµÄ_____________µć”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĪŽÉ«ČÜŅŗÖŠ£¬ĻĀĮŠĄė×ÓÄÜ“óĮæ¹²“ęµÄŹĒ£Ø £©
A.Mg2£«”¢SO42£”¢K £«”¢Cl£B.Na£« ”¢NH4£« ”¢NO3£”¢MnO4£
C.K £« ”¢Cu2£« ”¢Cl£”¢Br£D.Ba2£« ”¢Na£« ”¢NO3£”¢CO32£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ±ä»ÆÖŠ£¬±ŲŠė¼ÓČėŃõ»Æ¼Į²ÅÄÜ·¢ÉśµÄŹĒ£Ø £©
A.SO2”śSB.SO32£”śSO2C.I£”śI2D.KClO3 ”śO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄūÓĆŌŖĖŲµÄ»ÆŗĻ¼ŪĶĘ²āĪļÖŹµÄŠŌÖŹŹĒ»Æѧъ¾æµÄÖŲŅŖŹÖ¶Ī”£ČēĶ¼ŹĒĮņŌŖĖŲµÄ³£¼ū»ÆŗĻ¼ŪÓė²æ·ÖĪļÖŹĄą±šµÄ¶ŌÓ¦¹ŲĻµ£ŗ
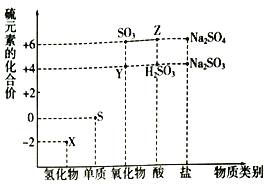
(1)“ÓĮņŌŖĖŲ»ÆŗĻ¼Ū±ä»ÆµÄ½Ē¶Č·ÖĪö£¬Ķ¼ÖŠ¼ČÓŠŃõ»ÆŠŌÓÖÓŠ»¹ŌŠŌµÄ»ÆŗĻĪļÓŠ______________(Ģī»ÆѧŹ½)((ĢīŅ»ÖÖ¾ĶæÉŅŌ)”£
(2)½«XÓėY»ģŗĻ£¬æÉÉś³Éµ»ĘÉ«¹ĢĢ唣øĆ·“Ó¦ÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ_______________”£
(3) ZµÄÅØČÜŅŗÓėĶµ„ÖŹŌŚŅ»¶ØĢõ¼žĻĀæÉŅŌ·¢Éś»Æѧ·“Ó¦£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ____________”£
(4)Na2S2O3ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£®“ÓŃõ»Æ»¹Ō·“Ó¦µÄ½Ē¶Č·ÖĪö£¬ĻĀĮŠÖʱøNa2S2O3µÄ·½°øĄķĀŪÉĻæÉŠŠµÄŹĒ_____________(Ģī×ÖÄø)”£
a£®Na2S+S b£®Na2SO3+S c£®SO2+Na2SO4 d£®Na2SO3+Na2SO4
(5)ŅŃÖŖNa2SO3Äܱ»K2Cr2O7Ńõ»ÆĪŖNa2SO4£¬Ōņ24 mL 0.05 mol/LµÄNa2SO3ČÜŅŗÓė 20 mL 0.02 mol/LµÄČÜŅŗĒ”ŗĆ·“Ó¦Ź±£¬CrŌŖĖŲŌŚ»¹Ō²śĪļÖŠµÄ»ÆŗĻ¼ŪĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¹ŲÓŚ»Æѧ·“Ó¦µÄŹµÖŹµÄĖµ·Ø²»ÕżČ·µÄŹĒ
A. »Æѧ·“Ó¦¶¼ÓŠŠĀĪļÖŹÉś³É
B. »Æѧ·“Ó¦¶¼ÓŠÄÜĮæ±ä»Æ
C. »Æѧ·“Ó¦ŹĒ¾É¼ü¶ĻĮŃŠĀ¼üÉś³ÉµÄ¹ż³Ģ
D. »Æѧ·“Ó¦µÄ·¢Éś¶¼ŠčŅŖŌŚŅ»¶ØĢõ¼žĻĀ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com