
元素周期表中,同主族元素从上到下,原子半径逐渐 (填“增大”或“减小”),元素的金属性逐渐 (填“增强”或“减弱”),非金属性逐渐 (填“增强”或“减弱”);同周期从左到右,原子半径逐渐 (填“增大”或“减小”),元素的金属性逐渐 (填“增强”或“减弱”),非金属性逐渐 (填“增强”或“减弱”).
考点:
元素周期律的作用.
分析:
同一主族从上到下原子半径增大,元素的金属性逐渐增强,非金属性逐渐减弱;同一周期从左到右,原子半径减小,元素的非金属性逐渐增强,金属性逐渐减弱,以此解答该题.
解答:
解:同一主族从上到下,原子核外电子层数逐渐增多,则原子半径逐渐增大,原子核对最外层电子的吸引能力减弱,则元素的金属性逐渐增强,非金属性逐渐减弱;
同一周期从左到右,电子层数相同,质子数增多,原子半径减小,元素的非金属性逐渐增强,金属性逐渐减弱;
故答案为:增大;增强;减弱;减小;减弱;增强.
点评:
本题考查元素周期律、周期表知识,侧重于基本规律的考查,注意相关基础知识的积累,难度不大.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
下列说法错误的是( )
|
| A. | 0.012kg 12C含有的12C是NA个 |
|
| B. | NA个水分子的质量是18g/mol |
|
| C. | 1mol O2中含有的氧气分子数为NA个 |
|
| D. | 含有NA个氧原子的H2SO4的物质的量是0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是()
A. 电解硫酸时,阴极产生1molH2时,阳极一定产生0.5molO2
B. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C. 电解1mol熔融的Al2O3,能产生33.6L氧气、54.0g金属铝
D. 工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子
查看答案和解析>>
科目:高中化学 来源: 题型:
关于化学键的下列叙述中,正确的是( )
|
| A. | 离子化合物一定含共价键 |
|
| B. | 共价化合物可能含离子键 |
|
| C. | 离子化合物中只含离子键 |
|
| D. | 共价化合物中肯定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表是化学学习和科学研究的重要工具,下列对于元素周期表的使用方法不正确的是( )
|
| A. | 为新元素的发现及预测它们的原子结构和性质提供线索 |
|
| B. | 利用元素周期表发现元素的种类和原子的种类相同 |
|
| C. | 在周期表中金属与非金属的分界处,可寻找半导体材料 |
|
| D. | 指导人们在过渡元素中寻找催化剂和耐高温.耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:
(1)写出下列元素的元素符号:A 、B 、D .
(2)A元素与氢元素形成的H2A化合物分子中,所含化学键为 键(填“离子”或“极性”或“非极性”),用电子式表示H2A的形成过程 , .
(3)A元素与E元素形成的化合物的化学式是 ,该化合物在物质分类中属于 氧化物.(填“酸性”,“碱性”或“两性”)
(4)向D元素与E元素形成的化合物的水溶液中滴加NaOH溶液,开始时,实验现象是 有 ,反应的离子方程式为 ;继续滴加NaOH溶液至过量,实验现象是 .
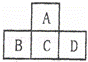
查看答案和解析>>
科目:高中化学 来源: 题型:
已知两个热化学方程式:C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol.现有炭粉和H2组成的悬浮气共0.3mol,使其在O2中完全燃烧,共放出87.71kJ的热量,则炭粉与H2的物质的量之比是()
A. 1:1 B. 1:2 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(1)该反应是 (填“吸热”或“放热”)反应.
(2)当反应达到平衡时,升高温度,A的转化率减小(填“增大”“减小”或“不变”),原因是 .
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”“减小”或“不变”).
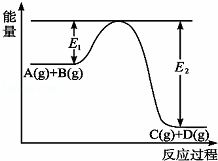
查看答案和解析>>
科目:高中化学 来源: 题型:
最近,媒体报道不法商贩销售“致癌大米”,已验证这种大米中含有黄曲霉毒素(AFTB),其分子结构式为如图所示,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能.一般条件下跟1mol AFTB起反应的H2或NaOH的最大量分别是( )
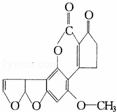
A. 6mol;1mol B. 5mol;1mol C. 6mol;2mol D. 5mol;2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com