
下列反应的离子方程式书写正确的是
A.碳酸钙溶于醋酸:CaCO3+2H+ Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
B.澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3- CaCO3↓+H2O
CaCO3↓+H2O
C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2 2Fe3++2Cl-
2Fe3++2Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相 同
同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二12月月考化学卷(解析版) 题型:选择题
若某溶液中有Fe2+和I-共存,要氧化I-而又不氧化Fe2+,可加入的试剂是( )
A. Cl2 B. KMnO4 C. HCl D. FeCl3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:选择题
下列离子组合,能大量共存的是
A.酸性溶液中:Al3+、Fe3+、SO32-、Cl-
B.透明溶液中:MnO4-、K+、Na+、NO3-
C.强碱性溶液中:Na+、NO3-、SO32-、HCO3-
D.强酸性溶液中:Na+、Fe2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:选择题
将一小块金属钠长期露置于空气中,最终的产物是
A.Na2CO3 B.Na2O C.NaOH D.Na2CO3·10H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上大考二化学卷(解析版) 题型:选择题
矿盐(主要成分是NaCl,还含有SO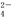 等其他可溶性杂质的离子),下列有关说法正确的是
等其他可溶性杂质的离子),下列有关说法正确的是
A.由矿盐生产食盐,除去SO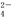 最合适的试剂是Ba(NO3)2
最合适的试剂是Ba(NO3)2
B.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
C.侯氏制碱法中,向饱和在食盐水中先通入二氧化碳,然后再通入氨气
D.工业上通过电解氯化钠溶液制备金属钠和氯气
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:填空题
下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb + PbO2+2H2SO4 2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同:据此回答:
2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同:据此回答:
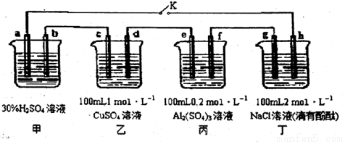
(1) a电极的电极材料是____________________ (填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为_____________________。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量是________________。
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为_______极,d电极上发生反应的电极反应式为_____________。
(5)电解后取amL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入 bmLCH3COOH溶液时,混合溶液的pH恰好等于7(体积变化忽略不计)。己知CH3COOH 的电离平衡常数为1.75×10-5,则a/b=________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:选择题
2.8gFe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后溶液中c(NO3)=0.85 mol/L
B.反应后的溶液最多还能溶解1.4 gFe
C.反应后溶液中铁元素可能以Fe2+形式存在
D.1.12L气体可能是NO、NO2的混合气体
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学卷(解析版) 题型:填空题
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
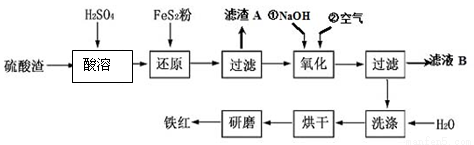
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ;“滤渣A”主要成份的化学式为 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O=15Fe2 + + SO42- + 。
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 ;
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是 (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)________________。
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com