
向0.1mol/I.的NH4HCO3溶液中逐渐加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数)。根据图象,下列说法不正确的是( )

A.开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O
B.当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C.pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-)
D.滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源:2016届湖北省沙市高三高考前最后一卷理综化学试卷(解析版) 题型:选择题
中国传统文化对人类文明贡献巨大,我国古代的人民在那时候就已经广泛应用了相关的化学知识,古化文献中充分记载了古代化学研究成果。下列关于古代化学的应用和记载,对其说明不合理的是
A.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳机诸药者”,这是利用了“KNO3的氧化性”
B.李白有诗云“日照香炉生紫烟”,这是描写“碘的升华”
C.《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是利用了“焰色反应”。
D.我国古代人民常用明矾水除去铜器上的铜锈〔Cu2(OH)2CO3〕
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月模拟四理综化学试卷(解析版) 题型:简答题
四川含有丰富的矿产资源,钒矿、硫铁矿、铜矿等七种矿产储量位居全国前列。回答下列问题:
(1)钒在元素周期表中的位置为 ,V3+的价电子排布图为 。
(2)钒的某种氧化物的晶胞结构如图1所示,其晶体的化学式为
(3)V2O5常用作SO2 转化为SO3的催化剂。SO2 分子中键角 120°(填“>”、“<”或“=”); SO3的三聚体环状结构如图2所示,该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个σ键。
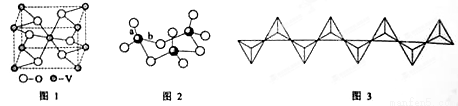
(4)V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ,例举与VO43-空间构型相同的一种阳离子和一种阴离子 (填化学式);也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
(5)硫能形成很多种含氧酸,如H2SO3、H2SO4。硫的某种含氧酸分子式为H2S2O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式 (配位键须注明)。
(6)利用铜萃取剂M,通过如下反应实现铜离子的富集:

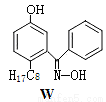
M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月模拟三理综化学试卷(解析版) 题型:选择题
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是

A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O
D.当固体电解质中有1mol O2-通过时,电子转移4mol
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三下学期猜题理综化学试卷(解析版) 题型:填空题
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)基态亚铜离子中电子占据的原子轨道数目为____________。
(2)若基态硒原子价层电子排布式写成4s24px24py4,则其违背了____________。
(3)左下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是____________(填标号)。
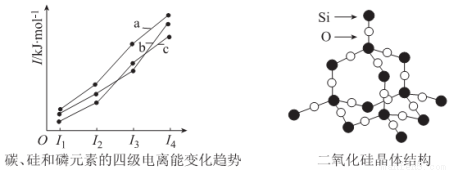
(4)单晶硅可由二氧化硅制得,二氧化硅晶体结构如右上图所示,在二氧化硅晶体中,Si、O
原子所连接的最小环为____________元环,则每个O原子连接____________个最小环。
(5)与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O.其结构如图所示,它的阴离子可形成链状结构。
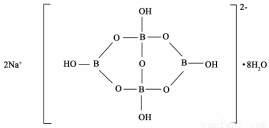
①该晶体中不存在的作用力是____________(填选项字母)。
A.离子键B.共价键C.金属键D.范德华力E.氢键
②阴离子通过____________相互结合形成链状结构。
(6)氮化嫁(GaN)的晶体结构如图所示。晶体中N、Ga原子的轨道杂化类型是否相同____________(填“是”或“否”),判断该晶体结构中存在配位键的依据是____________。

(7)某光电材料由锗的氧化物与铜的氧化物按一定比例熔合而成,其中锗的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为7.4g/cm3,晶胞边长为4.3×10-10m。则锗的相对原子质量为____________(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三下学期猜题理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值。下列说法中正确的有儿项( )
①1L0.1mol/LK2Cr2O7溶液中Cr2O72-的数目小于0.1NA
②1molCl2做氧化剂时得到的电子数为2NA
③25℃时,1LpH=12的碳酸钠溶液中含有Na+的数目为0.02NA
④过氧化钠与水反应时,生成0.5molO2转移的电子数为2NA
⑤50mL18.4mol/L的浓硫酸与足量的铜微热后反应,生成SO2分子数小于0.46NA
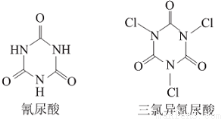
⑥利用氰尿酸与次氯酸在一定pH下反应可制备三氯异氰尿酸(结构如图).若原料完全反应,得到1mol产物同时生成3NA个H2O
A.2 C.4 B.3 D.5
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三高考打靶测试理综化学试卷(解析版) 题型:实验题
(14分)ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11℃,易溶于水,是常见的消毒剂。工业上常用二氧化硫还原氯酸钠(NaClO3)的方法制备ClO2,某学生拟用下图所示装置模拟工业制取并收集少量ClO2。
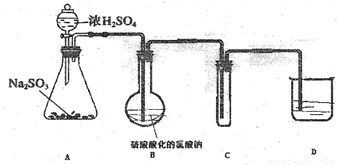
(1)下列制备气体所用装置与A装置相同的是_______________;
a.用过氧化氢与二氧化锰制氧气
b.用铜与浓硫酸制二氧化硫
c.用硫化亚铁与稀硫酸制硫化氢
d.只用浓氨水制氨气
(2)实验前,要检验装置的气密性,通常先___________________,将导气管插入盛有水的烧杯中,微热锥形瓶,若导管未端产生气泡,并在停止微热后,___________________,说明装置不漏气。
(3)二氧化硫与氯酸钠的反应需在75~90℃进行,为此,B装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、_________;写出B中产生二氧化氯的离子方程式_________________;
(4)C装置放在冰水浴中,其原因是_________________;
(5)用氢氧化钠溶液吸收ClO2,反应后可得到NaClO2与NaClO3混合液。
已知:NaClO2饱和溶液在较低温度时析出晶体NaClO2·3H2O,在较高温度时析出晶体 NaClO2;NaClO在高温时溶解度很大。
则从该混合溶液中获得晶体NaClO2的操作步骤为:①蒸发浓缩结晶;②_________;③洗涤干燥。
(6)碘量法可以检测水中ClO2的浓度,步骤如下:
①取1L水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝;(ClO2全部转化为NaClO2)
②用1.0×10-3 mol•L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液10.00mL;(已知:2S2O32-+I2═S4O62-+2I-)
确定操作②达到滴定终点的现象是_________________________________;
经计算,水样中ClO2的浓度是__________mg•L-1,若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____________;(填“偏高”、“偏低”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三全真模拟理综化学试卷(解析版) 题型:选择题
NA为阿伏加罗常数的值,下列说法中正确的是( )
A.44gCO2和N2O的混合物中含有的氧原子数为1.5NA
B.2L0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA
C.氢氧化钠与氯气反应时,生成0.1molNaCl转移的电子数为0.1NA
D.一定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
下列实验不能达到预期目的的是
①实验室用无水乙醇加热至170 ℃,可制得乙烯
②只用新制氢氧化铜悬浊液(可以加热)可将乙醇、乙醛、乙酸三种液体区别出来
③在混有杂质苯酚的苯中,加入适量溴水,过滤后得到纯净的苯
④在10%的NaOH溶液中滴入2%的CuSO4溶液至过量,再加入乙醛溶液加热至沸腾,溶液中有砖红色沉淀产生
⑤用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸
⑥将溴乙烷与NaOH溶液共热几分钟后冷却,滴入AgNO3溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在
A.①②④⑤ B.②③⑤⑥ C.①④⑤⑥ D.①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com