
【题目】已知乙酸异戊酯的密度为0.8670g·cm-1,是难溶水的液体。在洗涤、分液操作中,应充分振荡,然后静置,待分层以后获得乙酸异戊酯的操作是
A. 直接将乙酸异戊酯从分液漏斗的上口倒出
B. 直接将乙酸异戊酯从分液漏斗的下口放出
C. 先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D. 先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是
A. 1.12L H2 B. 1.12L O2 C. 2.24L H2 D. 2.24L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的平衡常数:
H2(g)+S(s)H2S(g),K1;
S(s)+O2(g)SO2(g),K2 .
则反应:H2(g)+SO2(g)O2(g)+H2S(g)的平衡常数为( )
A.K1+K2??
B.K﹣K2??
C.K1×K2??
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
A.
密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂
B.
反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
C.
物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应
D.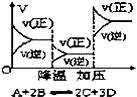
反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A,B,C是气体、D为固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列框图回答问题(答题时方程式中的M、E用所对应的元素符号表示): 
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式: .
(2)写出X生成Y的离子方程式: .
(3)某同学取Y的溶液,酸化后加入KI淀粉溶液,溶液变为蓝色.写出与上述变化过程相关的离子方程式: .
(4)写出将Cl2通入足量氢氧化钾溶液中反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同温度下水溶液中c(H+)与c(OH﹣)的关系,下列判断正确的是( ) 
A.两条曲线上任意点均有c(H+)×c (OH﹣)=Kw
B.T<25
C.b点和c点pH均为6,溶液呈酸性
D.只采用升温的方式,可由a点变成d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)
已知燃烧1kg该化合物释放出热量3.8×104kJ,油酸甘油酯的燃烧热为( )
A.3.8×104kJmol﹣1
B.﹣3.8×104kJmol﹣1
C.3.4×104kJmol﹣1
D.﹣3.4×104kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)将a mol钠和a mol铝一同投入m g足量水中,请用两个离子方程式表示有关生成H2的变化: . 该溶液的溶质质量分数为 .
(2)在标准状况下,22.4升的密闭容器中充入CO2和CO混合气体,其密度为10/7g/L,加入足量Na2O2充分振荡并不断用点火花点燃至完全反应,则容器中存在molO2 , molNa2CO3 .
(3)取一定量的镁铝合金,用足量盐酸溶解后,再加入过量的NaOH溶液,然后滤出沉淀物,加强热灼烧,最后得到白色粉末,干燥后称量,这些粉末与原合金的质量相等,则合金中铝的质量百分含量为 .
(4)已知2Fe2++Br2=2Fe3++2Br﹣ , 2Br﹣+Cl2=2Cl﹣+Br2 . 往100mLFeBr2溶液中缓慢通入2.24升氯气(标准状况),结果溶液中有三分之一的Br﹣被氧化成Br2 . 求原FeBr2的物质的量浓度 .
(5)部分氧化的Fe﹣Cu合金样品(氧化物为Fe2O3、CuO)共5.76g,经如图处理: 
根据题中条件计算V= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com