
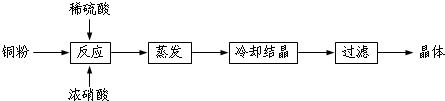
分析 (1)向含铜粉的稀硫酸中滴加少量浓硝酸,反应生成硫酸铜和NO、水;
(2)根据离子方程式分析计算;
(3)CuSO4和NaOH溶液反应方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,剩余的NaOH和HCl反应方程式为NaOH+HCl=NaCl+H2O,根据NaOH+HCl=NaCl+H2O计算参加反应的NaOH的物质的量,再根据CuSO4+2NaOH=Cu(OH)2↓+Na2SO4计算硫酸铜的物质的量,根据Cu原子守恒计算胆矾质量;
(4)滴定时要观察锥形瓶中颜色;根据滴定管的正确读数方法解答;
(5)滴定管未润洗,则盐酸的浓度减小,消耗的盐酸的体积偏大,计算出与盐酸反应的NaOH偏多,则与硫酸铜反应的NaOH偏少;
(6)相对误差为相对值除以准确值.
解答 解:(1)向含铜粉的稀硫酸中滴加少量浓硝酸,反应生成硫酸铜和NO、水,所以溶液变蓝色,同时生成无色的一氧化氮气体;
故答案为:溶液呈蓝色;有无色气体生成;
(2)向含铜粉的稀硫酸中滴加少量浓硝酸,反应生成硫酸铜和二氧化氮、水,其反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,反应中消耗2molNO3-和8molH+,2mol硝酸提供2mol氢离子,则另外6mol氢离子由硫酸提供,所以需要的硫酸为3mol,则硝酸与硫酸的理论配比(物质的量之比)为2:3;
故答案为:2:3;
(3)CuSO4和NaOH溶液反应方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,剩余的NaOH和H2SO4反应方程式为NaOH+HCl=NaCl+H2O,
参加该反应的n(NaOH)=n(HCl)=0.1000mol/L×0.02016L=0.002016mol,和CuSO4反应的n(NaOH)=0.1000mol/L×0.028L-0.002016mol=0.000784mol,根据CuSO4+2NaOH=Cu(OH)2↓+Na2SO4知,n(CuSO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.000784mol=0.000392mol,根据Cu原子守恒得n(CuSO4)=n(CuSO4•5H2O)=0.000392mol,胆矾的质量=250g/mol×0.000392mol=0.098g,
故答案为:0.098;
(4)滴定时要观察锥形瓶中颜色变化;在滴定中,准确读数应该是滴定管上蓝线的粗细交界点对应的刻度线;
故答案为:锥形瓶中溶液颜色变化;粗细交界点;
(5)滴定管未润洗,则盐酸的浓度减小,消耗的盐酸的体积偏大,计算出与盐酸反应的NaOH偏多,则与硫酸铜反应的NaOH偏少;而n(CuSO4)=$\frac{1}{2}$n(NaOH),所以计算得到的硫酸铜偏少,即测得试样中所含CuSO4?5H2O的质量偏小;
故答案为:偏小;
(6)相对误差为 $\frac{1.000g-1.015g}{1.015g}$×100%=-1.48%,故答案为:-1.48%.
点评 本题考查了物质含量的测定、实验现象等观察、物质的提纯、中和滴定、实验过程设计及有关计算,注意滴定管的使用,以及相对误差的计算方法,题目难度中等,侧重于考查学生的实验探究能力和计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
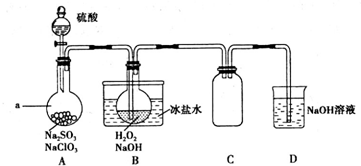
 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改善性能,增大用途 | |
| B. | 除去硫、磷和过多的碳,调整合金元素的含量 | |
| C. | 副产磷肥、水泥等 | |
| D. | 用红棕色炉气制取水煤气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、取代反应
、取代反应 、加聚反应
、加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃前甲烷不必验纯 | |
| B. | 甲烷燃烧能放出大量的热,所以是一种很好的气体燃料 | |
| C. | 煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生 | |
| D. | 甲烷是一种具有正四面体结构的很稳定的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com