
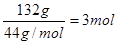 ��
��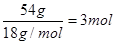 ������̼ԭ�Ӻ���ԭ�ӵ������ֱ���36g��6g�����������غ㶨�ɿ�֪���μӷ�Ӧ������������132g��54g��90g��96g�����ʵ�����
������̼ԭ�Ӻ���ԭ�ӵ������ֱ���36g��6g�����������غ㶨�ɿ�֪���μӷ�Ӧ������������132g��54g��90g��96g�����ʵ�����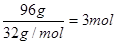 �������л�������ԭ�ӵĸ�����
�������л�������ԭ�ӵĸ�����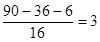 ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH��g�� ��H
CH3OH��g�� ��H

| A��2v(H2)(��) =v(CO)(��) |
| B�����������ܶȲ��� |
| C����������ƽ����Է����������� |
| D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 N2O4(g) ��H <0��ƽ�ⳣ�� K��13.3������������ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ���� c (NO2) =" 0.0300" mol��L��1��
N2O4(g) ��H <0��ƽ�ⳣ�� K��13.3������������ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ���� c (NO2) =" 0.0300" mol��L��1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2OH?+H2��+Cl2��
2OH?+H2��+Cl2��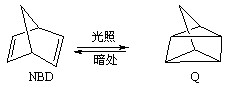 �����ø÷�Ӧ��������̫���ܣ���NBD�����ܱ�Q�����ܸ�
�����ø÷�Ӧ��������̫���ܣ���NBD�����ܱ�Q�����ܸ�| ��ѧ�� | N��N | H?O | N?H | O=O |
| ����/kJ��mol-1 | 945 | 463 | 391 | 498 |
 2NH3(g)+ 3/2O2(g)����H=+630kJ��mol-1
2NH3(g)+ 3/2O2(g)����H=+630kJ��mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��g��+
��g��+ 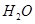 ��g��=
��g��=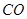 ��g��+
��g��+ ��g��
��g�� 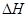 = +
= +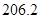
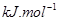
 ��g��+
��g��+ 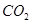 ��g��=
��g��=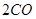 ��g��+
��g��+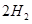 ��g��
��g��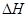 = +
= +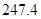
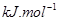
 ��g����
��g����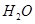 ��g����Ӧ����
��g����Ӧ����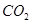 ��g����
��g����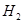 ��g�����Ȼ�ѧ����ʽΪ ��
��g�����Ȼ�ѧ����ʽΪ ��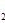 O���ȷֽ�Ҳ�ɵõ�H
O���ȷֽ�Ҳ�ɵõ�H ��������ˮ�ֽ���ϵ����Ҫ���������������¶ȵĹ�ϵ��ͼ��ʾ��ͼ��A��B��ʾ������������ �� ��
��������ˮ�ֽ���ϵ����Ҫ���������������¶ȵĹ�ϵ��ͼ��ʾ��ͼ��A��B��ʾ������������ �� ��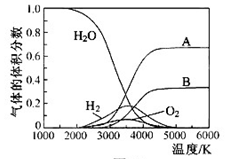
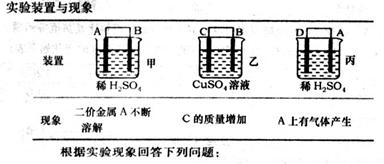
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������£���Na2CO3��Һ�м�������BaSO4��ĩ�����ˣ���ϴ���ij����м�ϡ���ᣬ�����ݲ�����������Ksp (BaCO3)��Ksp (BaSO4) |
| B�������£���ˮ�м����ƻ��������ƶ���ʹˮ�ĵ���ƽ�������ƶ���ˮ�����ӻ����� |
| C�������£���Ӧ4Fe(OH)2(s)+ O2(g) +2H2O(l) =4Fe(OH)3(s)�ġ�H��0����S��0 |
| D��Ǧ�����ڹ��������У������������٣������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2+NO ��H =" a" kJ/mol�ﵽƽ������¶ȣ�����������ɫ��dz�������ж���ȷ����
CO2+NO ��H =" a" kJ/mol�ﵽƽ������¶ȣ�����������ɫ��dz�������ж���ȷ����| A��a<0 |
| B�������¶ȣ������ʵ�Ũ�Ȳ��� |
| C�������¶ȣ�CO��ƽ��ת���ʽ��� |
| D��ʹ�ô����ܼӿ췴Ӧ���ʲ���߷�Ӧ���ƽ��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
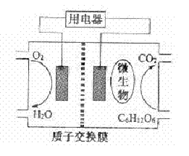
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com