
| A. | 将0.2mol•L-1氨水与0.2mol•L-1盐酸混合,c(NH3•H20)+c(NH4+)=c(Cl-) | |
| B. | 常温下NH4A溶液中的pH=6,则c(A-)-c(NH4+)=9.9×10-7mol•L-1 | |
| C. | c(NH4+)相等的NH4Cl,NH4HCO3溶液中,溶质初始浓度:c(NH4Cl)=c(NH4HCO3) | |
| D. | 将0.2molCO2缓慢通入含有0.3molNAOH的溶液中,c(CO32-)>c(HCO3-)>c(H2CO3) |
分析 A.两溶液恰好反应生成氯化铵,关键物料守恒判断;
B.计算出该溶液中的氢离子和氢氧根离子浓度,然后根据电荷守恒计算;
C.碳酸氢根离子促进了铵根离子的水解,则铵根离子浓度相同时碳酸氢铵的浓度稍大;
D.二者恰好反应生成等浓度的碳酸钠、碳酸氢钠,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-).
解答 解:A.将0.2mol•L-1氨水与0.2mol•L-1盐酸混合恰好生成氯化铵,根据物料守恒可得:c(NH3•H20)+c(NH4+)=c(Cl-),故A正确;
B.常温下NH4A溶液中的pH=6,该溶液中氢离子浓度为1×10-6mol/L,氢氧根离子浓度为1×10-8mol/L,根据电荷守恒可知:c(A-)-c(NH4+)=c(H+)-c(OH-)=9.9×10-7mol•L-1,故B正确;
C.c(NH4+)相等的NH4Cl、NH4HCO3溶液中,由于碳酸氢根离子的水解促进了铵根离子的水解,则铵根离子相同时溶质初始浓度c(NH4Cl)<c(NH4HCO3),故C错误;
D.将0.2molCO2缓慢通入含有0.3molNaOH的溶液中,反应生成等浓度的碳酸钠、碳酸氢钠,由于CO32-的水解程度大于HCO3-,溶液中正确的离子浓度大小为:c(HCO3-)>c(CO32-)>c(H2CO3),故D错误;
故选AB.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的灵活应用能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 它是氢的一种新同位素 | |
| B. | 这种新元素的核电荷数是3 | |
| C. | 它是H2的一种新同素异形体 | |
| D. | 它比一个普通氢分子多-个氢原子核 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80g | B. | 160g | C. | 98g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原铁和铝的物质的量相等 | |
| B. | 原盐酸的浓度为2mol•L-1 | |
| C. | 铁加入盐酸中的离子方程式为2Fe+6H+=2Fe3++3H2↑ | |
| D. | 盐酸与氢氧化钠溶液的物质的量浓度之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
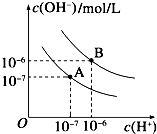 已知水在25℃和95℃时的电离平衡曲线如下图所示:
已知水在25℃和95℃时的电离平衡曲线如下图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,N2和H2的转化率相同且c(N2):c(H2)=1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 将1 L0.5mol/L的浓盐酸加热浓缩为0.5L | |
| D. | 从1000mL 1mol/L NaCl溶液中取出100 mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500℃、30 MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2+3H2?2NH3△H=-38.6kJ•mol-1 | |
| B. | 已知在105Pa,298K条件下,2mol H2燃烧生成水蒸气放出484kJ热量,则其热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1 | |
| C. | 甲烷的标准燃烧热数值为890.3kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| D. | 已知稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1mol水时放出的热量为57.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com