
| A. | 凡吸热反应均需在加热条件下才能发生 | |
| B. | 离子化合物中不可能含有共价键 | |
| C. | 液氨作为清洁能源的反应原理是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | |
| D. | 实验收集NO和乙烯常用排水法不能用排空气法 |
分析 A.吸热反应与是否加热无关;
B.离子化合物中可能含共价键;
C.NO有毒,为空气污染物;
D.NO易被氧化,乙烯的密度与空气密度接近,二者均不溶于水.
解答 解:A.吸热反应与是否加热无关,如氯化铵与氢氧化钡常温下反应,C与二氧化碳高温下反应,均为吸热反应,故A错误;
B.离子化合物中可能含共价键,如NaOH中含离子键和共价键,故B错误;
C.NO有毒,为空气污染物,液氨作为清洁能源,应转化为氮气和水,故C错误;
D.NO易被氧化,乙烯的密度与空气密度接近,二者均不溶于水,则实验收集NO和乙烯常用排水法不能用排空气法,故D正确;
故选D.
点评 本题考查化学键、氧化还原反应及反应中能量变化,为高频考点,把握化合物中的化学键、化学反应能量变化与反应条件、物质的性质等为解答的关键,侧重分析与应用能力的考查,注重基础知识的夯实,题目难度不大.


科目:高中化学 来源: 题型:推断题
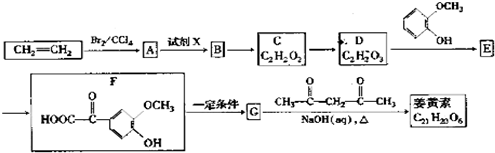

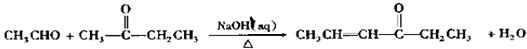
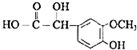 ;
;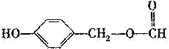 ;
;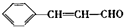 ),写出制备肉桂醛所需有机物的结构简式
),写出制备肉桂醛所需有机物的结构简式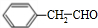 、CH3CHO.
、CH3CHO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ga(OH)3酸性强于Al(OH)3 | B. | Al(OH)3酸性强于Ga(OH)3 | ||
| C. | Ga(OH)3碱性强于Al(OH)3 | D. | Al(OH)3碱性强于Ga(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 241Am的中子数与电子数之差为146 | B. | 241Am与243Am的质子数相等 | ||
| C. | 241Am与243Am是同素异形体 | D. | 241Am与243Am的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | pH=2的醋酸用水稀释至原体积10倍后,溶液中H+的数目大于0.001NA | |
| C. | 常温常压下,92g NO2和N2O4的混合气体含有的氧原子数为4NA | |
| D. | 500mL0.2mol•L-1的MgSO4溶液中,SO42-所带负电荷数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
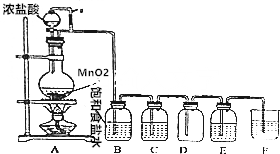 如图是实验室制取并探究氯气化学性质的装置图
如图是实验室制取并探究氯气化学性质的装置图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol | B. | 3 mol | C. | 2.5mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
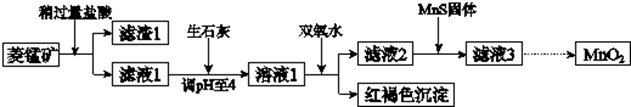
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com